基因治疗发展的重大历史事件,基因编辑技术引领新时代
图注:来自MIT News
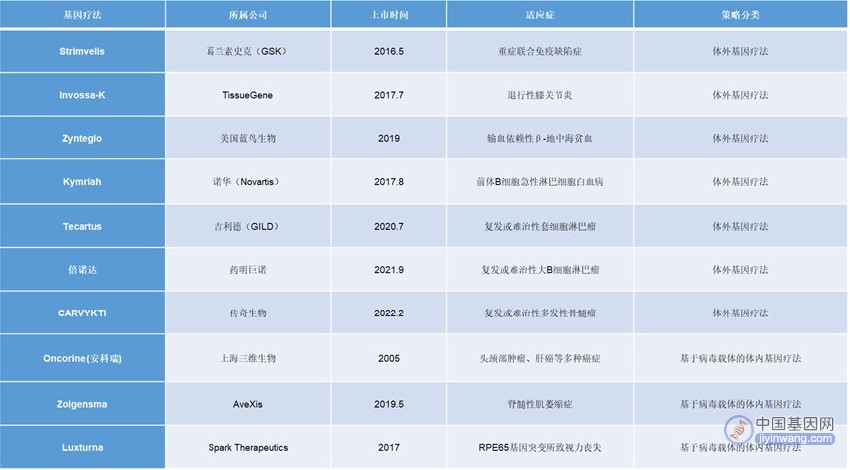
1970年,基因治疗的概念初次问世,即替换和修复单个的致病基因。在此基础上,科学家开发出了不同的方法纠正或影响基因功能,并且将这些技术运用到血液病,退行性眼病和肌肉疾病的治疗中。随着技术进步,科学界逐步拓展了基因治疗的初始定义,即在原有概念的基础上增加利用前沿工具修复基因错误。截至目前,全球共有45款基因治疗药物获批上市。在过去的2022年也有9种基因治疗药物获批上市。适应症遍及遗传性自体免疫病,血液病,神经性疾病以及实体和非实体肿瘤。技术路线也包含了CAR-T,重组病毒,以及RNAi。
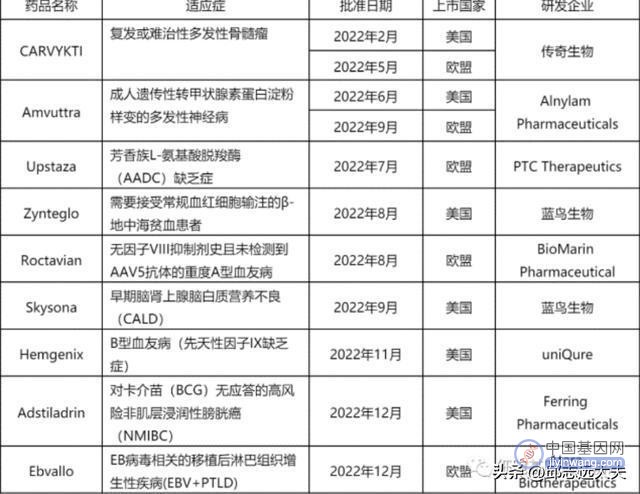
图注:2022年上市9款基因治疗药物
01
基因治疗概述
基因治疗的两种基本途径
1)抽出病人血液,并在实验室内重编程特定细胞,最后重新输注至病人体内;
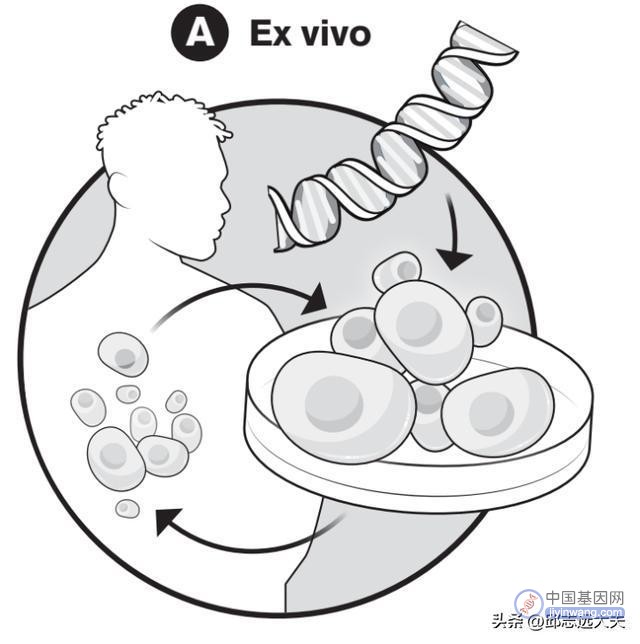
图注:离体基因治疗途径
2)直接将基因治疗材料传送回病人体内(往往是眼睛,但随着技术进步,传送目的地从眼睛拓展到肝脏和心脏)。
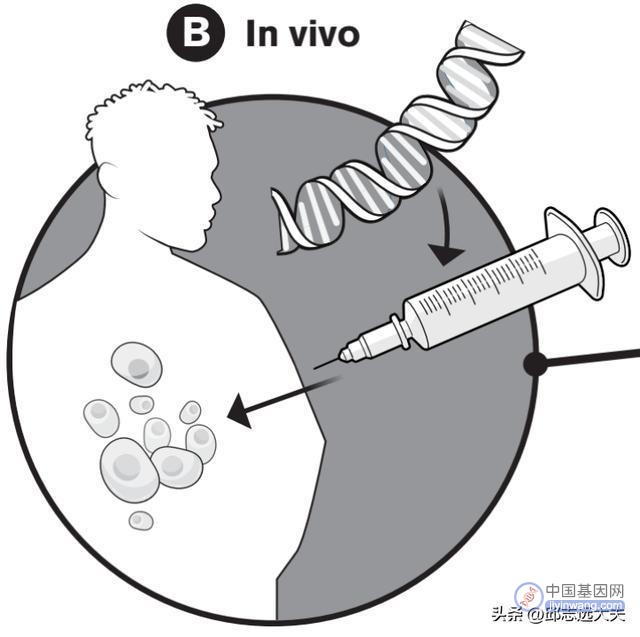
图注:在体基因治疗途径
基因治疗的三大技术原理
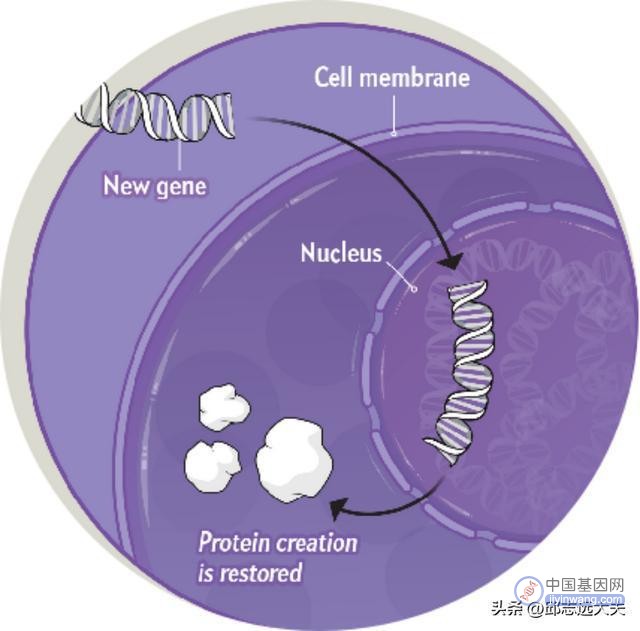
1)将健康基因直接导入细胞,弥补某些疾病中基因的缺失和故障。
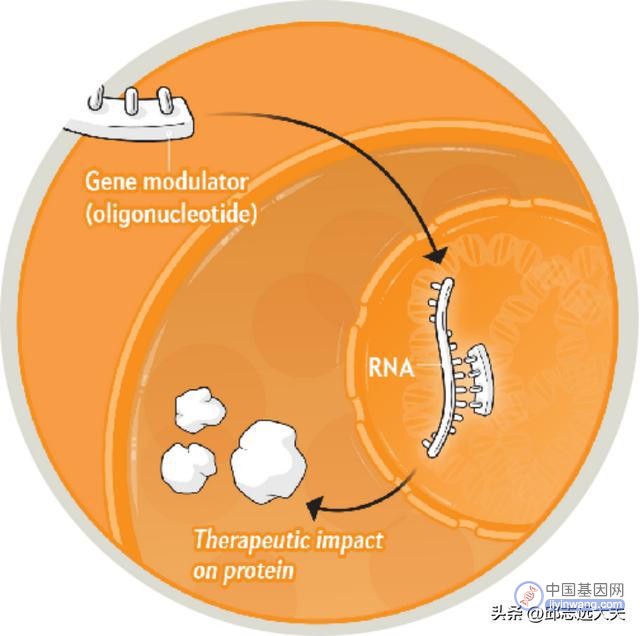
2)调节现存的基因活力。即利用短序列核苷酸和寡核苷酸去影响细胞内基因表达为蛋白质的过程。
3)基因编辑。利用CRISPR-Cas9等技术精确剪切哺乳动物基因组,修正疾病受累细胞中特定基因的错误。
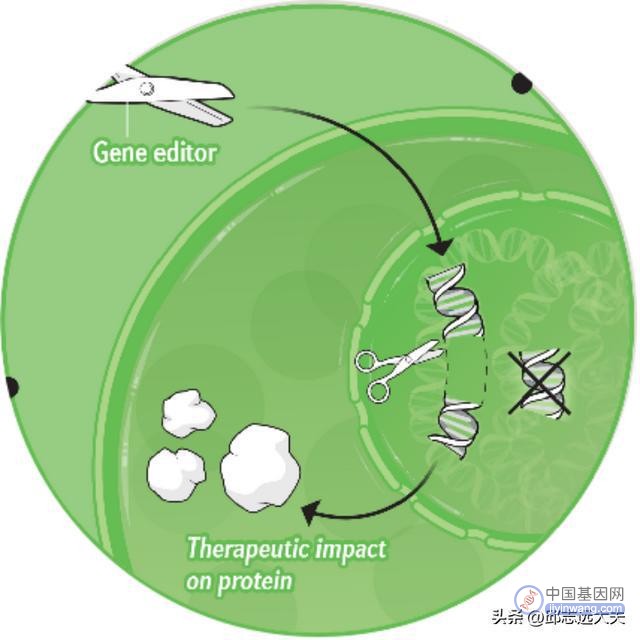
基因治疗的递送载体
为了克服基因治疗的相关副反应,靶向特异性组织并且不引起免疫应答,提高递送效率,减少治疗成本,科学家在递送系统的研究和选择上做出了很多尝试。
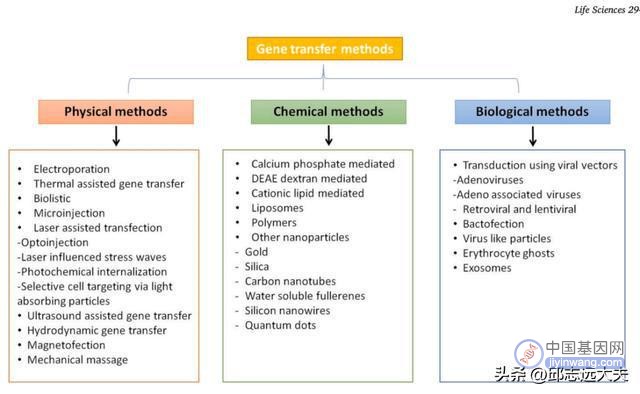
图注:三大递送方法
其中腺相关病毒(AVV)和逆转录病毒载体在基因治疗中的应用极为广泛。
AAV优势在于以下几点:
1)递送的基因货物都是以分散或者游离的状态存在的,而不是稳定整合至基因组内。如此而来,致癌可能性变小。
2)体积小则可以影响多种细胞并且在组织中有效扩散。
其缺点在于:
1)缺乏持久性。因其持久性取决于治疗性基因在宿主细胞内存在的时间。而慢病毒则可携带更大更复杂的基因,并且倾向于将基因整合进入编码区域,可在最小化患癌风险的同时延长病人获益时间。
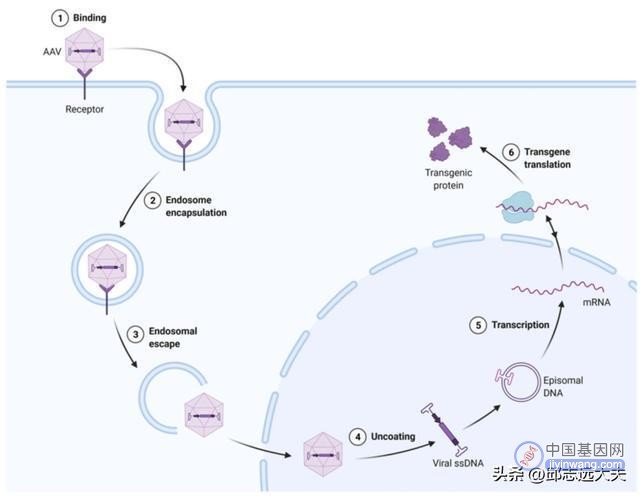
图注:AAV介导的基因治疗
02
基因治疗发展的重大历史事件
基因治疗的初次尝试
1990年,两个严重免疫缺陷的女孩迎来了他们生命中的曙光,她们均患有先天性腺苷脱氨酶缺乏症,严重的免疫缺陷使他们的生命受到了威胁。而经过基因治疗技术导入正常的腺苷脱氨酶基因后,患儿的免疫能力得以提高。在治疗期的18-24个月的时间内,每个孩子都接受了超过12剂的药物治疗,并且症状得到了缓解,这表明该研究获得了明显并且积极的效果。
该项目由美国国立卫生院主导并且也是世界上人体基因治疗的首次临床试验,该临床试验为生物医学的发展开启了重要篇章。自此,全球范围内都掀起了基因治疗研究的热潮。
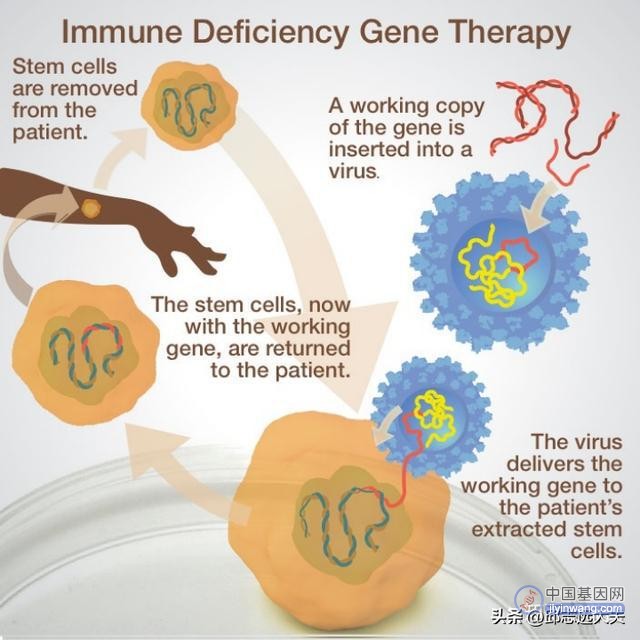
图注:基因治疗先天性免疫缺陷
基因治疗在曲折中前进
在基因治疗如火如荼展开的同时,研究者们在其中发现了一些严重甚至致命的副作用。这些副作用不但引起了科学界广泛的反思,有的也阻止了研究者前进的脚步。
1999年,18岁的Gelsinger在接受基因疗法治疗代谢性肝脏疾病的过程中因免疫系统的过度活跃而死亡。2003年研究者报道了相关研究,即某些接受基因治疗的先天性免疫缺陷病人最终发展出了白血病,这是因为某些载体病毒会将基因材料整合至基因组的促癌区域。在这以后的很长一段时间内,基因治疗的研究基金枯竭,临床试验也因此停滞,很多研究者将目光转向改良病毒载体和清除额外基因以及辅助化合物治疗使基因治疗更安全,更有效率,更易到达靶细胞。
基因治疗挽救遗传性视网膜疾病
莱泊尔先天性黑蒙病(LCA)是人类的一种遗传性眼病,这种眼病会使视网膜无法感光以及向大脑传递信息。患者往往表现为不受控制的眼球颤动,并最终在40岁之前完全失明。
1993年,研究人员发现RPE65基因是遗传性视网膜疾病的病因之一,眼科医生Bennett和Magurie两夫妻便以RPE65基因为研究对象,尝试开发出治疗LCA的基因疗法。他们利用无毒的腺病毒相关载体(AAV)将正常RPE65基因注射进入视网膜底部以控制疾病的进展。
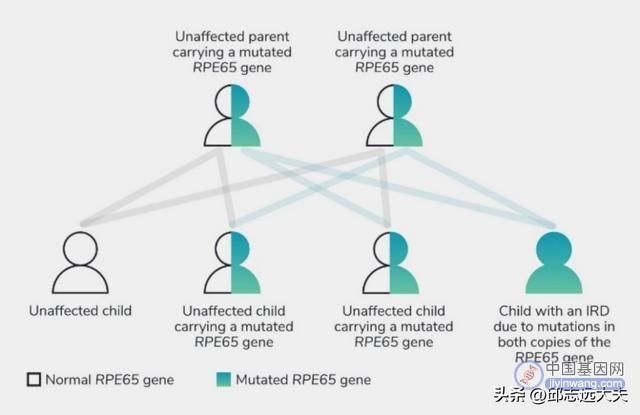
图注:突变型RPE65基因遗传图谱
在经过一系列的临床试验之后,FDA最终于2017年批准了Luxturna治疗由RPE65基因突变引起的遗传性视网膜疾病(包括2型LCA和色素性视网膜炎)。这也是FDA获批的首批体内基因治疗药物。Luxturna的试验结果是喜人的,那些已经失明的患者在接受药物注射之后通常会迅速恢复视力,尽管还并未明确药物发挥效应的持续时间,但是一项2019年公布的追踪数据表明,20位接受治疗的患者在三年后依旧没有丧失视力,甚至在五年后的追踪随访中也得到了相似的结果。Luxturna的获批无疑为遗传性眼病的患者带来福音。
图注:Luxturna的注射装备
过继细胞疗法打击癌症
2010年,宾夕法尼亚大学和马里兰大学的研究人员报道了利用基因疗法治疗白血病和淋巴瘤的正面结果。该研究的原理是训练和增强患者的免疫系统以监测和摧毁癌症细胞,因此研究人员需要在免疫细胞上设计和装配一些基因去识别和杀死肿瘤。
其中研究最为深入的CAR-T(嵌合抗原受体T细胞免疫疗法)。
流程如下:研究人员将目标基因通过逆转录病毒输送至T细胞内,再将改装后的T细胞回输至病人体内,杀灭癌细胞。
宾夕法尼亚大学的这项临床研究结果如下:52位接受CAR-T疗法tisagenlecleucel的急性淋巴细胞白血病(ALL)的患者中有29位患者得到了疾病的缓解。基于此项研究,FDA于同年批准了这项CAR-T疗法用于治疗ALL,并于次年批准可用于治疗弥漫性大B细胞淋巴瘤。彼时一次治疗的花费高达475000美元,有“天价治疗”之称。
2020年一整年,Kymriah(tisagenlecleucel的商品名)治疗ALL的缓解率大约为85%,超过一半的患者一年之后仍没有复发。诺华公司表示他们计划对患者展开15年的回访以明确Kymriah持续效用时长。自此后多项CAR-T疗法通过FDA审批用于治疗淋巴瘤,白血病和多发性骨髓瘤等血液肿瘤。

图11
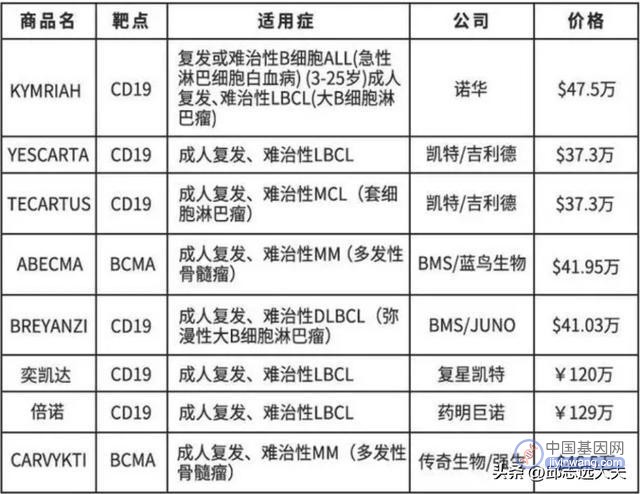
图注:CAR-T疗法上市概览
CAR-T疗法的成功,引起了学界对基因疗法本质的思考。究其根本,CAR-T疗法并没有解决基因功能紊乱的问题,而是赋予T细胞肿瘤杀手的属性。结合基因治疗的初始定义,很多人对这种疗法是否为基因治疗展开了讨论。如何定义基因治疗也成为一个灰色领域。
寡核苷酸治疗解救致命性基因疾病
同上文所述的过继细胞疗法相同,RNAi和反义核苷酸药物也陷入了同样的境地。因其原理并不是纠正现有基因,而是利用短序列核苷酸和寡核苷酸去影响细胞内基因表达为蛋白质的过程。
首先我们来了解RNAi介导基因沉默的过程:
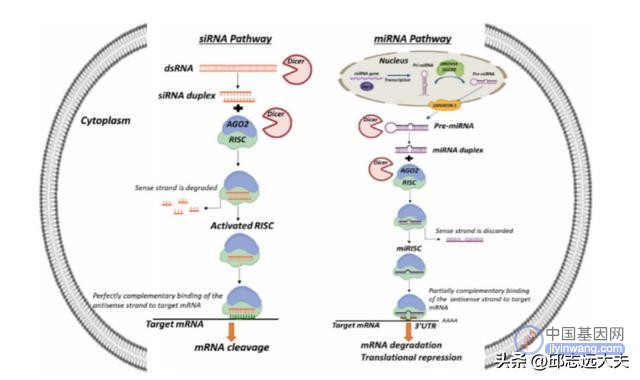
图注:RNAi介导基因沉默的机理
图中左半边揭示的是小干扰RNA(siRNA)沉默基因的途径,当将其应用于基因治疗时,就是将合成的siRNA转染进入细胞或器官内部使其与RISC-AGO2组装并进一步活化,最终导致靶标mRNA的有效降解和抑制。
而图中右半边则阐述的是miRNA沉默基因的途径,它也可以以与siRNA相似的方式阻止靶标mRNA的翻译。
关于寡核苷酸调节蛋白质表达有这样一个经典的成功案例:
脊髓性肌肉萎缩症(SMA)是一种由运动神经存活蛋白(SMN)低水平表达导致的神经性疾病。这种疾病一般在婴幼儿时期就会得到诊断,其中的四种分型是依据疾病的严重程度和细胞产生SMN的能力而划分的。在最严重的Ⅰ型SMA病例中,维持基本功能如呼吸,端坐或者吞咽对病人来说都是巨大的挑战。诊断为Ⅰ型SMA的婴儿在一年内有90%的概率死亡,可以称得上人类生命和健康的一大杀手。
在人体中可以表达SMN蛋白的同源基因有两种:一种是SMN1(超过90%包含外显子7);另一种是SMN2(大约10%包含外显子7)。这导致SMN1主要合成功能性的SMN蛋白,而SM2主要合成截断的非功能性的SMN蛋白(SMNΔ7)。而在SMA病人体内,SMN1因突变或缺失无法形成功能性的SMN蛋白,并且仅剩的SMN2基因只能少量表达功能性SMN蛋白而不足以弥补SMN1丢失所造成的影响。
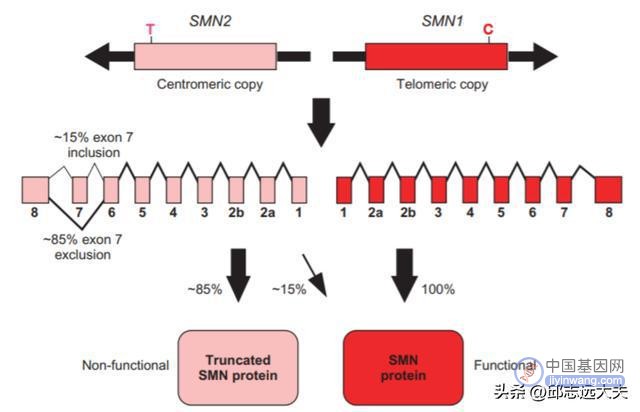
图注:两种SMN基因的转录
Nusinersen就是一种诱导功能性SMN蛋白表达的反义寡核苷酸药物(ASO),该药物由Biogen和伊奥尼斯制药(Ionis)联合开发,并于2016年被FDA批准用于治疗儿童和成年SMA患者。 该药物的基本原理是其可以与SMN2前体mRNA外显子7的下游内含子相结合,从而诱导成熟mRNA包含外显子7(避免切除),并以此增加功能性SMN蛋白的产量。
在一项旨在研究Nusinersen对初生发病SMA治疗效果和安全性的随机、双盲、假对照试验中,研究人员在间歇分析中发现相对于空白对照组,给药组患者的运动里程碑应答率显著提高[21/51(41%) vs. 0/27(0%)],并且在终期分析中研究人员也得到了相似的结果。该结果也发表在新英格兰医学杂志上。
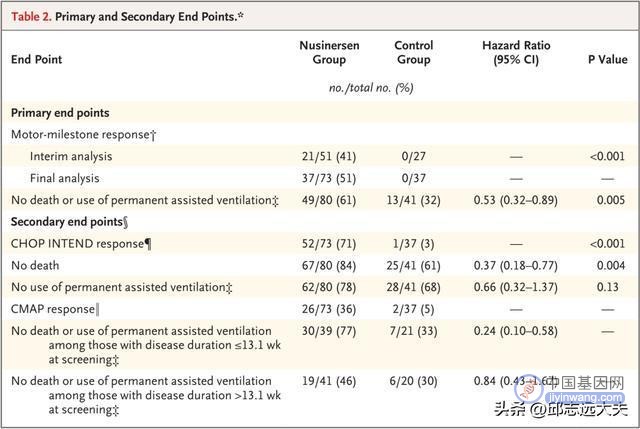
图注:NCT02193074临床试验结果
自该药品上市以来,全球范围内已有超过10000人获益。尽管该治疗不能完全使患者的运动功能恢复至正常,但它却帮助患病人群延长了生命并且获得了更有质量的生活。其中最令人瞩目的是,对于一些早在出生前就通过基因诊断确定患病的新生儿来说,出生后立马给药或许会阻止疾病的发生。
基因编辑技术引领基因治疗新时代
2012年,Emmanuelle Charpentier 和Jennifer DouDNA发现了CRISPR-Cas9系统并且凭此共享了2020年的诺贝尔化学奖,该系统的发现可以说是基因治疗发展的一大里程碑,它放弃了直接传送健康基因转而过渡到准确修复细胞内基因。

图注:2020年诺贝尔化学奖获奖者
CRISPER-Cas9的原理如下:
该系统是在细菌中发现的一种免疫防御机制,它可以监测入侵病毒的特定DNA,并且指导酶剪切和破坏病毒基因组。根据这一原理,研究人员利用这套系统精确剪切哺乳动物基因组。在7年的时间内该技术也从体外实验拓展到人体试验。
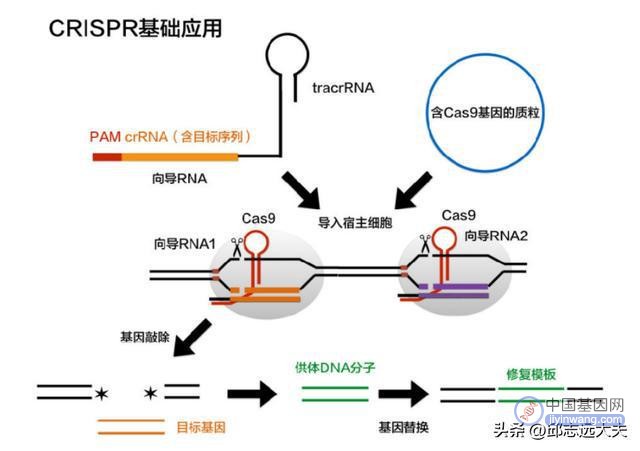
图注:CRISPER-Cas9应用于基因敲除和基因替换
全球范围内有数以万计的人患有镰刀细胞病。该病的主要表征是镰刀状红细胞的大量产生,这些形状异常的红细胞比健康的红细胞更加粘稠、坚硬,它们往往会导致血管堵塞,贫血甚至致命的结果。
而β型地中海贫血也是由于单个突变导致的血红蛋白产能减少的一种血液疾病。对于这两种血液病,主要的治疗方法是输血以及对症治疗某些并发症,只有一部分找到合适骨髓配型的患者才可以通过骨髓移植治愈疾病,并且该部分患者也面临着相对较高的并发症风险和较长时间低下的生活质量。
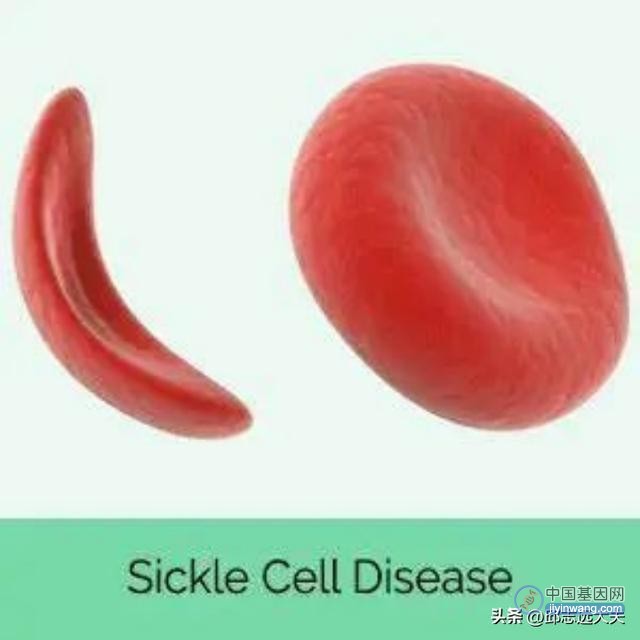
图注:镰刀状细胞病
而基因编辑治疗为这两类遗传疾病带来了曙光。某些临床试验开始利用体外编辑方法治疗镰刀细胞病和β地中海贫血。2021年6月Vertex制药联合CRISPR医疗宣布了一项利用CTX001(一种CRISPR-Cas9疗法)治疗上述两种疾病的研究结果:15例β地中海贫血患者在接受治疗后三个月内血红蛋白水平迅速提高并且无需输血,7例镰刀细胞病的患者也拥有相似的获益并且在三个月内没有经历严重的疼痛。
CTX001是通过基因编辑患者的造血干细胞,降低BCL11A基因的表达,从而使患者体内胎儿血红蛋白(HbF)上升(HbF是一种携带氧气的血红蛋白,在出生时自然存在,然后转换为成人形式的血红蛋白),缓解两种疾病的贫血症状。
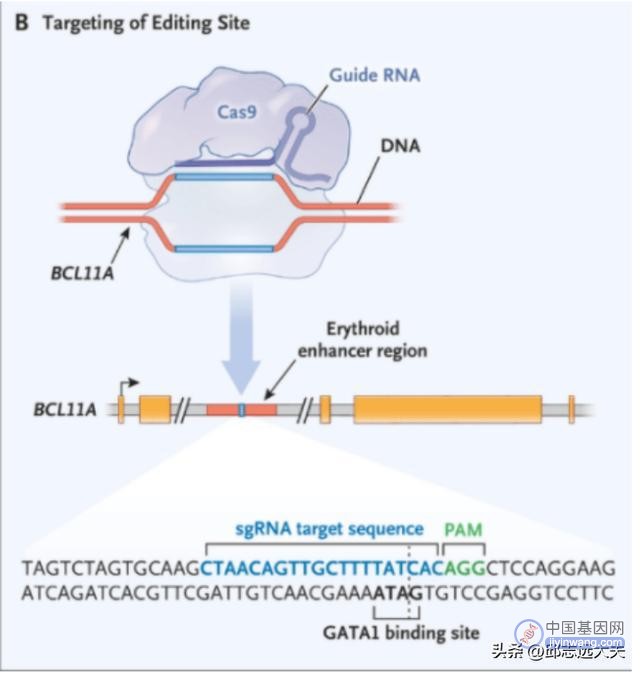
图注:CTX001治疗原理
03
展望
在该篇文章中,小编带大家回顾了基因治疗发展史中几大重要事件,在科学快速进步的时代背景下,基因治疗又是如何博采众长在曲折中前进的。越来越多的证据证明,基因治疗是拥有极大潜力的治疗策略。基因治疗可以克服许多传统药物不可及的缺陷,例如:化学药物耐药性以及无法修正基因缺陷等。然而,基因治疗仍然面临极大挑战,如:研发安全高效的基因递送载体;针对昂贵基因疗法的公共医疗保险覆盖;提高基因疗法的可及性;消除大众对基因疗法的偏见(弥合治疗现状与大众心中想象的落差);完善基因疗法试验终点的设计等 。
参考文献:
1.https://www.nature.com/articles/d41586-021-02734-w
2.https://www.nature.com/articles/d41586-021-02736-8
3.https://www.nature.com/articles/d41586-021-02737-7
4.Sayed N, Allawadhi P. Gene therapy: Comprehensive overview and therapeutic applications. Life Sci. 2022 Apr 1;294:120375. doi: 10.1016/j.lfs.2022.120375. Epub 2022 Feb 3. PMID: 35123997.
5.药融云数据库
6.Barresi V, Musmeci C, Rinaldi A, Condorelli DF. Transcript-Targeted Therapy Based on RNA Interference and Antisense Oligonucleotides: Current Applications and Novel Molecular Targets. Int J Mol Sci. 2022 Aug 9;23(16):8875. PMID: 36012138; PMCID: PMC9408055.
7.Finkel RS, Mercuri E; ENDEAR Study Group. Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy. N Engl J Med. 2017 Nov 2;377(18):1723-1732. doi: 10.1056/NEJMoa1702752. PMID: 29091570.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。