一出生就患上绝症,蓝鸟公司这种基因疗法让他获得新生
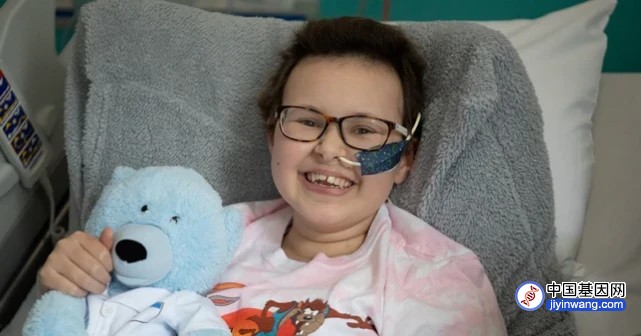
躺在病床上的小男孩康纳·赫斯(Conner Hess)在前不久刚接受了一场干细胞移植手术,用于治疗他刻在基因密码中的疾病——脑性肾上腺脑白质营养不良(CALD)。小康纳的母亲里歇尔·布鲁克斯(Richelle Brooks)在看到小康纳安然回到病房后终于放下了悬着的心,无法抑制地哭泣起来。她知道,数百万个携带着能治疗小康纳基因缺陷的干细胞正在在她的宝贝的身体里流淌,这将挽救他年轻而脆弱的生命。
“你的干细胞正在重新回到你的身体里,宝贝。”里歇尔在小康纳的床边说道,并不停地擦拭着泪水。
一场始于十多年前的生命接力
2017年,小康纳在接受新生儿缺陷基因筛查时就被发现携带着导致CALD的基因缺陷。医生说,小康纳有很大的可能会在几年后发病,并迅速死亡。这给小康纳一家带来了巨大的恐慌。CALD是一种由ABCD1基因突变引起的主要影响男性的X染色体连锁代谢疾病,这种突变影响了肾上腺脑白质营养不良(ALD)蛋白的产生,随后会导致极长链脂肪酸(VLCFAs)在肾上腺、大脑与脊髓的白质等重要组织中不正常地积累。该病的症状通常在患儿4-10岁时显现,导致其认知能力及包括听力、视力和运动能力在内身体能力的迅速丧失。更可怕的是,这些能力的丧失往往在症状首次出现后的几个月内就会发生,大多数患儿会在几年内死亡。
由于这是一种极其罕见的遗传病,在全美可能仅有数百名患者,该病此前并没有受到过多的关注。直到十多年前,一位来自纽约布鲁克林母亲的努力让这一切发生了改变。
2011年时,爱丽莎·西格女士(Elisa Seeger)的儿子艾丹(Aidan)在上一年级时莫名其妙地出现了视力障碍。在艾丹接受了一系列的检查后,医生告诉爱丽莎,艾丹被确诊为CALD,并且已经产生了严重的脑损伤。尽管在确诊后小艾丹马上接受了干细胞移植手术,但为时已晚。次年,年仅7岁的小艾丹就离开了人世。

Aidan Seeger(图片来源:ALD Alliance,Elisa Seeger)
没有被丧子之痛击垮,爱丽莎在艾丹去世后反而将悲伤化为了动力,她为ALD患者成立了一个患者倡导组织,并开始游说美国各个州的政府让他们把基因缺陷筛查添加到新生儿的常规筛查项目中。
“如果我们在艾丹2004年出生时就知道这些信息,我儿子现在就还会在这儿,但我们没有,”爱丽莎说道,她不想让更多的家庭遭受和她一样的痛苦了,因为这一切原本都是有可能避免的。
通过爱丽莎的努力,2012年时,纽约率先把基因突变筛查加入到了新生儿的常规检查中。十年后的今天,全美已经有36个州实现了对新生儿的强制基因突变血液筛查。因此,在小康纳出生后仅数天,康纳的父母就知道他有可能会患上这种凶险的恶疾,这为后续他们应对随时可能来袭的病魔预留了充足的准备时间。
“刚收到这些消息的时候简直是一场恶魔,但回头看看,这是一个真正的祝福,”里歇尔感叹道。
疾病蔓延,救命良方及时出现
由于这些基因筛查的结果,小康纳不得不定期接受大脑的磁共振成像(MRI)检查——大约三分之一被筛查出缺陷基因的患者会这样做,以监测自己是否已经患上了这种最具破坏性的疾病。不幸的是,去年9月份时,恶魔的身影最终还是出现在了小康纳的MRI检查图像上。
“很明显,症状将会像野火一样开始蔓延,”治疗康纳的神经学家兼麻省总医院的CALD专家弗洛里安·艾奇勒(Florian Eichler)博士是这么形容康纳的病的。
留给小康纳的时间可能不多了,但他的治疗选择却非常有限。过去30多年间,干细胞移植几乎是唯一经过验证的能够治疗CALD的有效方法。捐赠者的干细胞能够进入骨髓、增殖并随着血液进入大脑,然后在大脑中变成一种被称为小胶质细胞的中枢神经系统保卫细胞。在CALD患者中,这些细胞似乎可以阻止由于基因缺陷引起的脂肪酸的积累,从而阻止脂肪酸破坏神经细胞周围的保护鞘。
然而,对于CALD患者来说,找到合适的干细胞捐赠者很难。首先,来自陌生捐赠者的干细胞通常很难匹配,并可能会引起严重的移植物抗宿主病。通常这时候,我们会选择来自兄弟姐妹的干细胞。但由于CALD是一种家族性的遗传病,患者的兄弟姐妹也很有可能具有相同的遗传缺陷,导致他们没有资格捐献细胞。现实情况也是如此无情,康纳13岁的哥哥也携带着同样的缺陷基因,但他哥哥却比较幸运,到目前为止都没有发病。
波士顿儿童医院(Boston Children’s Hospital)的移植专家克里斯汀·邓肯(Christine Duncan)博士表示,此类患者的兄弟姐妹能够成为干细胞捐献者的几率通常只有不到四分之一。
就在小康纳的治疗几乎陷入僵局时,转机出现了——2022年9月,一款名为Skysona的基因疗法获批上市了!这是FDA批准的用于治疗早期CALD的首款基因疗法,刚好和小康纳的病对症。而且这种全新的疗法能够避开寻找干细胞捐赠者的难题,患者需要做的就是配合医生从自身血液中提取干细胞,然后在实验室中将功能良好基因插入这些细胞,最后将它们输回自己体内。

在此前的临床研究中,这种来自于患者自身的改良干细胞与来自于健康兄弟姐妹捐赠的干细胞一样,能有效地阻止疾病的恶化,并且比陌生捐赠者的干细胞更好。在一项对CALD患者进行的长达两年的临床试验中,接受单剂Skysona治疗的32名儿童中有91%成功存活了下来,并且没有出现任何严重的功能障碍。研究人员表示,还有另外35名儿童在后续研究中接受了治疗,同样取得了良好的成果。
在得知Skysona成功上市的消息后,小康纳的家人和为他进行治疗的医生们都欣喜若狂,这个幼小的生命或许有救了!
深思熟虑后踏出勇敢的一步
不过,在做出最终的治疗决定前,作为Skysona临床试验的监督者之一,邓肯博士表示有必要将这款药物的更多情况对小康纳的父母进行详细说明,使他们对Skysona的治疗效果及其潜在的风险有一个正确的预期。如果他们最终选择接受治疗,小康纳将成为该疗法上市后的第一个使用者。
邓肯博士的告诫并不是没有缘由的——这种基因疗法似乎阻止了大多数患者因神经功能衰退变成植物人的状态,或是面临更可怕的死亡,但使用该疗法并非没有严重的风险。在Skysona的临床试验中,接受治疗的67名儿童中有3名患上了据信与基因治疗有关的血液癌症。邓肯博士表示,虽然这种癌症也有治疗的方法,但考虑接受基因治疗的家庭必须权衡其中的风险。
作为医生,邓肯博士必然会尽最大的努力治疗患者,并希望小康纳日后能过上相对正常的生活。但家长们也必须意识到,接受治疗后的小康纳仍需要服用类固醇来弥补与CALD相关的肾上腺素缺乏症,在他成年后,也还是可能会出现周围神经损伤,并影响他的行走能力,严重的甚至需要坐轮椅。当然,邓肯博士也不能保证不会出现其他问题。

这些告知令小康纳的父母很难抉择,母亲里歇尔在最初听到这项新上市的疗法的时候持怀疑态度,它真如医生说得那么神奇吗?以及这项疗法可能存在的危及生命的风险——尽管概率较小,她也不得不更加谨慎。但当她在波士顿儿童医院的官网上看见,十年前首个在临床试验中接受Skysona治疗的爱尔兰男孩现在仍能健康地驰骋在足球场上,并挂着灿烂笑容的照片时,她下定了决心。
“那一刻,”里歇尔说,“我不再怀疑了。”如果小康纳有可能像那个爱尔兰男孩一样健康地体验更多美好的时光,作为母亲,她必须抓住每一个可能的机会。
随后,医生便按计划为小康纳进行了Skysona治疗。今年的1月10日,医生们从小康纳的血液中收集了足够多的干细胞,然后利用慢病毒载体,在体外将ABCD1基因的功能性拷贝导入到这些收集起来的造血干细胞中,制造用于回输的干细胞。等小康纳结束为期8天的清髓治疗,为这些经过改造的干细胞腾出生长空间后,终于在3月16日这天,他完成了干细胞的回输。所有医护人员都为手术的成功感到兴奋。
接受干细胞回输两周后,小康纳的白细胞计数结果表明,他经过改良的干细胞在他体内工作良好,并有望防止CALD的继续恶化。不久前,小康纳似乎已完全恢复了手术前的活力,高兴地在床上玩起了电子游戏。医生说,他最早周日就能出院。小康纳的父母对他们的儿子能够过上相对正常的生活也表示乐观。
后记
开发Skysona疗法的蓝鸟(bluebird bio)公司表示,小康纳获得成功治疗的案例只是一个开始,预计今年还将有5到10名患者会在美国三个有资格进行治疗的医院接受治疗。
在艾丹的母亲爱丽莎推动的新生儿基因缺陷筛查和Skysona疗法的共同作用下,有望被彻底改变未来的家庭将会越来越多。截至今年1月的数据,仅马萨诸塞州就有近30万名新生儿接受了基因缺陷筛查,并从中发现了22名携带ABCD1基因突变的患儿。如果像小康纳一样进行定期的监测,并及早进行干预,他们的人生或许也将有很大的不同。
随着医生、科学家和生物医药公司研发人员在创新疗法方面的不断探索和进步,我们期待,未来能有更多像Skysona这样挽救生命的疗法被开发出来,造福更多的患者及其家庭。
参考资料:
[1] A young boy’s nightmare diagnosis, and the $3 million one-time treatment that will likely save his life. Retrieved April 4, 2023, fromhttps://www.statnews.com/2023/04/03/cald-bluebird-skysona/
[2] bluebird bio Receives FDA Accelerated Approval for SKYSONA® Gene Therapy for Early, Active Cerebral Adrenoleukodystrophy (CALD). Retrieved April 4, 2023, fromhttps://www.businesswire.com/news/home/20220916005595/en
[3] FDA Advisory Committee Unanimously Endorses eli-cel Gene Therapy for Cerebral Adrenoleukodystrophy. Retrieved April 4, 2023, fromhttps://www.businesswire.com/news/home/20220609006060/e
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。