细胞基因治疗大变革?美国尝试高价药物新付费模式
上周,美国FDA加快批准了Iovance公司的肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifileucel),针对晚期黑色素瘤患者。这标志着全球首个TIL疗法的批准,同时也是第一个针对实体瘤的T细胞疗法。
今日,药明康德宣布,其子公司药明生基(WUXI ATU)获FDA批准,在其费城基地进行Amtagvi的分析测试和生产。
药明生基是药明康德旗下专注于细胞和基因疗法的CTDMO业务部门,为Iovance的Amtagvi提供从研究、临床生产到获得FDA批准的药物研发全流程支持。”
近期,以Amtagvi为代表的多款细胞基因治疗产品在美国市场迎来好消息,同时,见智研究也关注到,美国联邦医保在1月底宣布了一项新的细胞基因治疗付费方式的探索,可能为过去几年陷入商业化难题的细胞基因产品带来新的增量。
细胞基因治疗定价模式的新尝试
由于细胞疗法定价高企,相关疗法获益的人群一直有限。近期美国针对细胞治疗开启了一种新的尝试,企图降低整体费用。

CMS(美国联邦医疗保险和医疗补助服务中心)的方法是使用细胞和基因治疗(CGT)访问模型。先期计划将两个用于治疗镰状细胞病的CGT纳入模型,两者都于2023年12月获得批准。
二者分别为Vertex Pharmaceuticals和CRISPR Therapeutics的“Casgevy”,每名患者标价为220万美元;
以及来自bluebird bio的“Lyfgenia”,定价为每名患者310万美元。
简单来讲,这个计划就是通过更长时间的患者获益程度和联邦保险的类带量采购,来降低价格。
根据CMS,这项计划是通过基于结果协议(Outcomes-Based Agreement, OBA)支付给制造商的款项,而付费数目与一定时间内患者的健康结果挂钩,同时CMS也希望挂钩药品销量。
1、在该模型下,如果基因治疗在长期改善健康结果方面的成功率低于预期,药物制造商将向医疗支付方退还部分治疗费用。协议还将包括其他价格让步,如基于数量的回扣或保证回扣。
2、CMS将代表各州与制造商就为Medicaid为主要支付方的受益人提供的细胞和基因治疗进行谈判。该模型允许CMS将各州聚集在一起,进行多州基础上的谈判,而不是每个州都与制造商建立自己的OBA。
3、CMS还将负责建立财务和临床结果衡量标准、协调数据和评估结果。各州仍将负责支付细胞和基因治疗的费用,但价格回扣将根据CMS谈判的特定结果而确定。
这些组合模式不仅可以降低患者和保险提供者的经济风险,还能激励制药企业和医疗服务提供者不断优化和改进治疗方案。
同时,CMS还表示随着效果显现,后续还将对更多细胞基因治疗药物采用这种付费模式。
这并不是细胞疗法第一次尝试按疗效付费。除了海外一些基因疗法推出疗效不达预期部分退款外,中国国内也出现多款细胞疗法的相似付费模式,但相比更为简单。
今年1月,复星凯特的CAR-T产品推出“治不好退一半钱”商业推广计划,尝试加速商业化进程。药明巨诺表示,公司在2021年9月产品上市之初就推出了多元创新支付方案,包括金融分期、按疗效付费等。
显然,在细胞基因治疗付费突破上,美国又一次走在世界前列。
正如华尔街见闻·见智研究在《美国高药价谈判,你需要知道这些 | 见智研究》中谈到的,美国政府正在对高药价采取行动,而这些行动并不只是媒体报道最多的10款药品降价谈判上。
毛利率一直为负的WUXI ATU,会迎来拐点吗?
此次获批的Amtagvi的上市定价,同样高达每位患者515,000美元。
与CAR-T产品类似,TIL疗法也是通过提取患者的免疫细胞(T细胞),在实验室中进行扩增或改造后,再输回患者体内,利用这些细胞对癌细胞的识别和杀伤能力进行治疗。
全球首款TIL产品的获批,对药明生基(WUXI ATU)而言意义重大,在过去几年中,受制于高额的价格,全球细胞和基因疗法的发展速度相对于其他治疗手段而言有所放缓,同时新产品数量的增长也较为有限。
这些行业现状导致药明生基的产能利用率一直较低,ATU部分毛利率长期为负,成为药明康德5个业务板块中唯一利润为负的板块。
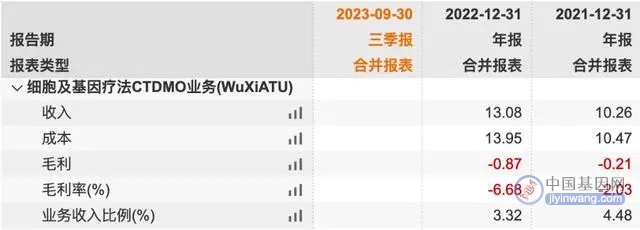
随着细胞和基因治疗领域近期连续传来积极消息,同时药明生基商业化领域获得更多产品订单,产能利用率将有所提升,毛利率有望迎来改观。

根据药明康德在JPM大会上的演示材料,公司目前ATU部分的商业化产品从此前的1个增加到2个,并且新增产品位于美国市场。
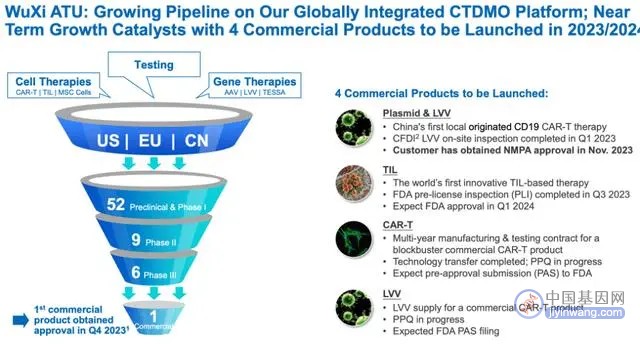
CDMO的商业化订单的金额与药品上市后的销售规模有关,如果药品销量好,订单数量可能是临床阶段订单的几倍到几十倍不等。
考虑到细胞基因治疗的特殊性,其临床试验患者规模通常仅为几十人,致使临床阶段的订单量相对较小。因此,一旦相关药品上市,预期CDMO的商业化订单增长将会更为迅速,为CDMO方带来更大的业务增长潜力和产能利用率的提升。
作为第一个获批的TIL细胞治疗产品,Amtagvi用于治疗在接受过抗PD-1/L1疗法和靶向治疗后进展的晚期黑色素瘤患者。根据美国癌症协会的估计,今年美国将诊断出97,000多例新的黑色素瘤,预计将有近8,000人死于黑色素瘤。
在过去十年中,PD-1和靶向治疗极大地改善了晚期黑色素瘤的治疗效果。然而,仍然有很大一部分患者对这些疗法没有反应或最终复发,且进展后治疗选择有限。根据Iovance提交的BLA数据,Amtagvi总体响应率(ORR)比例为31.4%。
市场报告预测,TIL疗法市场的复合年增长率为40%,研究范围包括黑色素瘤、头颈癌、慢性淋巴细胞白血病、肉瘤、肝细胞癌、乳腺癌、急性髓细胞白血病和宫颈癌等适应症。
不过,Amtagvi并不是药明生基的第一款商业化产品。去年底,中国第四款获批的CAR-T产品成为药明生基商业化阶段的突破。
不过,由于中国患者的支付能力显著弱于美国市场,因此在美国获批的Amtagvi将成为检验药明生基业绩的试金石。
结语
美国在细胞和基因治疗领域的全新付费模式探索,相信也会被更多国家参考。引入这样的付费模式后,整个产业链都将受益。
对于制药企业来说,这种模式提供了一个更大的市场潜力,因为它有助于减轻治疗成本的压力,使得更多患者能够接受治疗。
对于医疗保险公司和政府支付机构而言,这种模式有助于控制医疗支出,确保资金用于效果最显著的治疗上。
对于患者,这不仅意味着更广泛的治疗机会,也意味着他们的治疗更有可能得到经济上的支持。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。