全球第35个艾滋病日,基因疗法治疗艾滋病有何新进展
今年的12月1日是第35个“世界艾滋病日”。自1981年世界第一例艾滋病病毒感染者发现至今,短短40多年间,艾滋病在全球肆虐,已成为重大公共卫生问题和社会问题,引起了世界卫生组织及各国政府的高度重视。为号召全世界人民行动起来,团结一致共同对抗艾滋病,世界卫生组织于1988年1月在伦敦召开了"全球预防艾滋病"会议,宣布每年的12月1日为"世界艾滋病日”。

2022年艾滋病日主题
为进一步推动新时代艾滋病防治工作的高质量发展,全面营造全社会参与艾滋病防治工作的良好氛围,国务院防治艾滋病工作委员会办公室确定今年我国的宣传活动主题为“共抗艾滋 共享健康”。
从1981年报告全世界第一例艾滋病病人,到目前全球范围内现存艾滋病毒(HIV)携带者和艾滋病患者人数高达3800万人。截至2021年底,全球有65万人因艾滋病失去生命,每年新增艾滋病病毒感染者超过150万人。
在中国,据报道每年约有13-15万人成为新发感染者。(2019年1月-10月统计数据)在全国法定传染病疫情报告中,艾滋病患者病死人数也居首位,占所有传染病致死人数的80%左右。
在艾滋病治疗方面,自1996年发现鸡尾酒疗法(鸡尾酒疗法是通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病),并推广及全世界以来,艾滋病整体病死率在显著下降。广泛应用此疗法后,我国艾滋病病死率已由2003年的22.8/百人/年下降到了2014年的3.1/百人/年,去年这个数字已经降至3/百人/年以下。
由于找到了艾滋病从致命变为慢性的治疗方法,许多患者的生活的确得到了改善。然而,在找到能够永久治愈患者的治疗方法之前,我们还有很长的路要走。
基因及细胞疗法在治疗艾滋方面的策略
艾滋病是由于感染艾滋病毒引起的,这种病毒会攻击人体的免疫系统,进入人体后它会大量破坏人体免疫系统中最重要的CD4+T细胞,之后经过数年或更长的潜伏期后使人体几乎丧失免疫功能,进而发展成艾滋病患者。患者通常因抵抗力极度下降而后出现多种感染,后期常常发生恶性肿瘤,以至全身衰竭而死亡。世界范围内仍然缺乏有效的治疗艾滋病病毒感染的药物。目前的治疗目标是最大限度和持久地抑制患者体内的病毒复制,使患者能够重建和维持免疫功能,同时降低艾滋病毒感染和非艾滋病相关疾病的发病率和死亡率。
HIV长期驻留在宿主中,避开免疫系统和抗逆转录病毒治疗,能够在宿主中存活数年。由于静默的被感染宿主细胞的持续存在,HIV目前尚无法治愈。
在基因及细胞治疗领域,可能的HIV治愈策略有以下几种:(1)基因编辑技术(2)阻断和锁定(3)休克和杀伤(4)嵌合抗原受体细胞治疗,如图2、3所示:
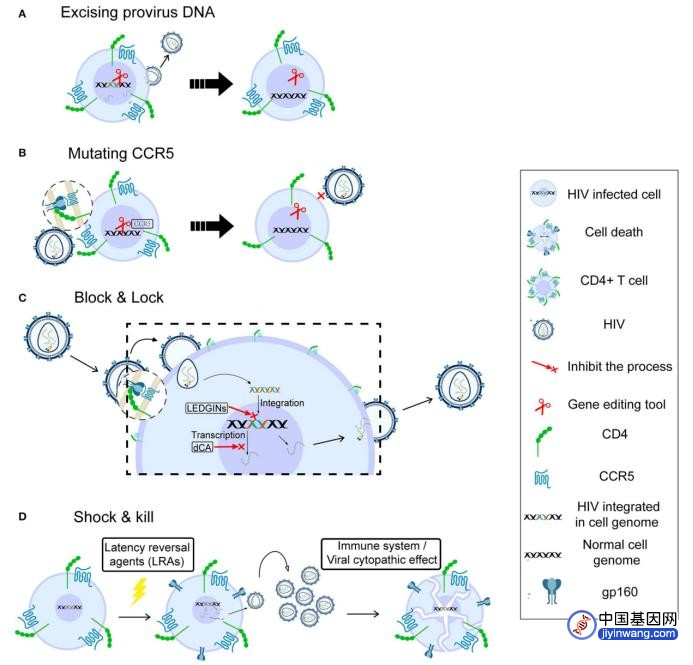
图2:几种HIV治愈策略
基因编辑技术
使用基因编辑工具治疗HIV感染主要有两种策略(图2A、2B):第一种是通过切除原病毒(provirus)基因组进行治疗,例如靶向LTR区域的CRISPR/Cas9,可从潜伏感染的CD4+ T细胞中切除整合的HIV原病毒;第二种策略是阻止新的感染,通过基因编辑的方法改造细胞,突变病毒感染所需的受体(CCR5),从而阻断病毒感染,旨在功能性治愈。
阻断和锁定策略
通过阻断新病毒基因整合到细胞基因组并永久沉默HIV潜伏库来治愈HIV的方式,被称为阻断和锁定(Block and Lock)策略。(图2C)
激活和杀伤策略
治疗感染的方法“shock and kill”使用了潜伏期逆转剂(LRAs)来强制感染的细胞再次产生HIV(“shock”阶段),同时维持抗逆转录病毒疗法(ART)以防止发生新的感染。HIV的再次转录会导致激活细胞,被ART直接或间接杀死(“kill”阶段)。(图2D)
嵌合抗原受体细胞治疗技术
嵌合抗原受体(CAR)含有三个结构域,特异性结合抗原的细胞外结构域(受体),锚定受体的跨膜部分和转移信号的内结构域,研究人员可以设计CAR来识别特定抗原并激活CAR表达的效应细胞。以HIV特异性CAR-T为例:从HIV患者中收集CD8+T细胞并用CAR基因转导;在体外验证抗HIV特异性和有效性后,将功能性HIV特异性CAR-T细胞重新注入患者体内以杀死HIV感染细胞(图3)。
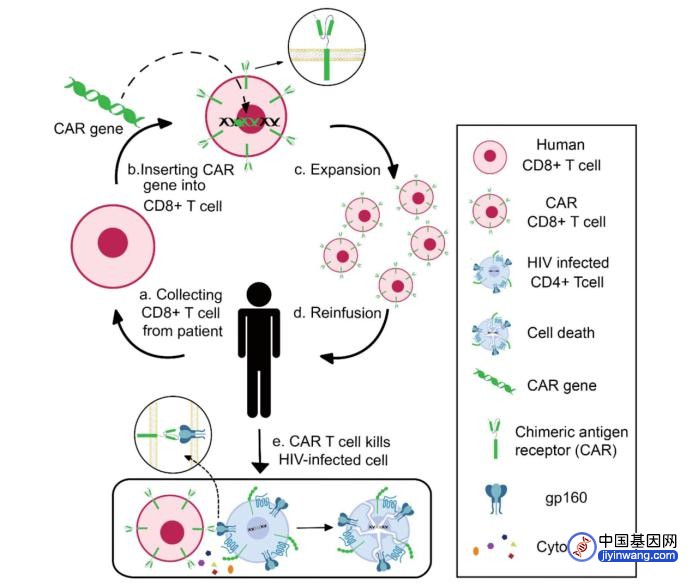
图3:HIV的CAR-T治疗
基因/细胞治疗艾滋病的近期进展
基因编辑技术——EBT-101的初步尝试
EBT-101 是一种独特的、临床阶段的体内基于 CRISPR 的治疗剂,旨在单次静脉输注后治愈 HIV 感染。EBT-101采用腺相关病毒 (AAV) 来传递 CRISPR-Cas9 和双向导 RNA,从而实现了一种同时靶向 HIV 基因组内三个不同位点的多重编辑方法,2022 年 7 月EBT-101 完成了首例受试者给药。
然而11月17日,Editas公司宣布,暂停全球首个体内基因编辑疗法EBT-101的临床研究。背后原因,或许是由于EBT-101的疗效不及预期。体外基因治疗药物,体内基因编辑技术临床也被阶段性的按下了暂停键。
阻断和锁定策略——ABX464
法国生物技术公司Abivax的药物ABX464有望成为一种HIV功能性治愈疗法,其关键潜力在于可靶向隐藏在细胞内病毒储存库中不活跃的HIV病毒。
当前的治疗方法是通过抑制新病毒的形成抑制循环系统中的病毒载量,并不能触及病毒储存库中的病毒。一旦治疗停止,HIV病毒会在10-14天内卷土重来。ABX464是有史以来首个能减少病毒储存库的候选药物。
ABX464能与HIV病毒RNA中的特定序列结合,抑制病毒的复制。在IIa期临床研究中,患者接受抗逆转录病毒治疗的同时还接受了ABX464治疗,数据显示,接受28天治疗后,15例患者中有8例患者病毒储存库水平降低25-50%,而仅接受抗逆转录病毒药物治疗的患者病毒储存库没有减少。
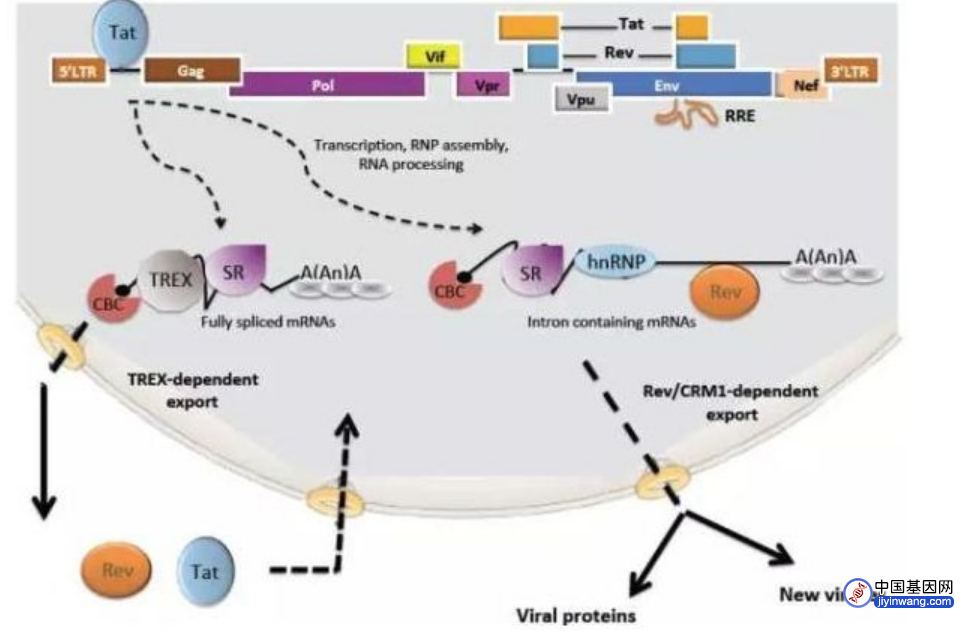
图4:ABX464 的作用机制
2022年4月6日,Abivax公布了候选药物ABX464治疗溃疡性结肠炎(UC)2b期临床试验的中期进展,分析结果表明该药物具有良好的安全性和耐受性,能够随着使用时间的延长提高治疗效果,而其在HIV方面的研发未更新最新进展,仍处于IIa临床阶段。
嵌合抗原受体细胞——duoCAR-T治疗艾滋病
Careing Cross今年8月中旬宣布其在研双嵌合抗原受体T细胞疗法duoCAR-T治疗艾滋病的1/2a期临床试验成首例患者给药,至今接受治疗的患者暂未出现与药物相关的不良反应。值得一提的是,这项旨在评估抗HIV duoCAR-T细胞治疗的不同单剂量方案安全性和耐受性的临床试验也是首个双嵌合抗原受体T细胞疗法用于治疗HIV的人体临床研究。
其实,早在90年代后期就已经有研究人员将CAR-T疗法应用于HIV感染,而这是基于这样一个事实:HIV病毒的感染始于其外壳蛋白(称为包膜糖蛋白)与免疫细胞上的CD4受体结合。对此,研究人员制造了以CD4受体为靶点的抗HIV CAR-T。然而却发现CD4的CAR使得工程T细胞更容易感染HIV。
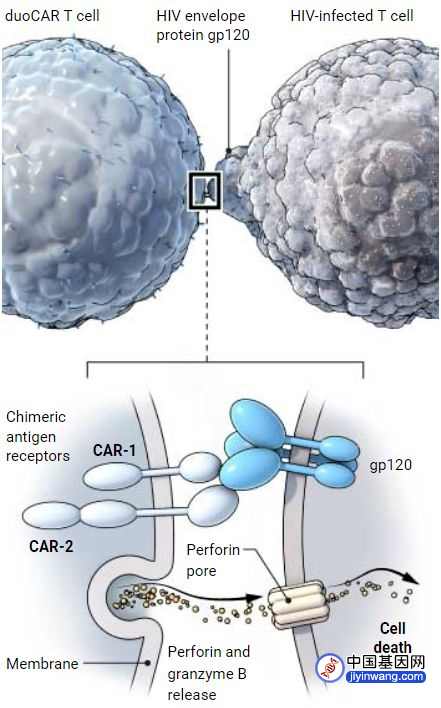
图5:duoCAR-T的作用原理
为了克服这一问题,Lentigen的BoroDropuli 及其同事开发了40多种基于HIV的慢病毒载体,并筛选出了两种最佳的两种CAR分子,即mD1.22-CAR和m36.4-CAR(D13),可以靶向HIV外壳上的三个特定结合位点,由此产生的CAR-T疗法也被称之为“duoCAR-T”。而这一设计也使得HIV难以通过改变其表面蛋白的某些区域来躲避T细胞的攻击。
在临床前实验中,6只小鼠有5只没有检测到存在于脾脏的HIV DNA,平均病毒水平下降了97.5%。此外,研究还表明duoCAR-T细胞的持续存在可以赋予长期抑制HIV的能力。
随着I/IIa期临床试验的第一个参与者的给药,嵌合抗原受体细胞治疗艾滋病已经达到了一个重要的里程碑,这项临床试验达到的主要目标已确定这是具有安全性的且有前途的治疗方法。
据公开信息披露,2021年全球艾滋病治疗药物市场规模达到380亿美金,而国内仅不到4亿美金。目前,国内大部分治疗艾滋病的药物都是20年前上市的老药物,仿制药及免费赠药方式也使得国内创新药企在这一领域布局者较少。
但一个事实是艾滋病患者亟需更为有效甚至达到治愈的治疗手段。对于创新药企来说,在治愈艾滋病领域做一些探索或许会给未来带来更大的竞争力。舒泰神(300204)针对目前艾滋病细胞治疗领域遇到的问题,也进行了组合策略的设计,尝试克服难题,目前相应的细胞治疗研究处于临床前阶段。我们也期待更多创新疗法惠及广大患者。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。