基因治疗载体新辅助--植物源重组人血清白蛋白
基因治疗,是一种利用基因载体将外源的正常基因或有治疗作用的基因导入靶细胞,以纠正或补偿缺陷/异常基因引起的疾病,从而达到治疗目的的技术。基因治疗的成功实施离不开基因载体发挥的巨大作用,基因载体如同一个运载工具,可以将目的基因运送到目的细胞中。
一、基因载体分类与安全
出色的基因载体应具有基因递送效率高、基因释放及表达效果好、细胞相容性好、体内应用免疫原性低等优点。目前,基因载体包括两类:病毒载体和非病毒载体。
病毒载体:目前病毒载体仍然是临床试验的主流载体,超过2/3的临床试验选用了病毒作为载体。当前在基因治疗领域使用最广泛的病毒载体包括逆转录病毒 (retro virus, RV) 和慢病毒(lentivirus, LV) 、腺病毒 (adeno virus, Adv) 以及腺相关病毒 (adenoassociated virus, AAV) 等载体。2017年,The Journal of Gene Medicine 曾统计,腺病毒、逆转录病毒是当时临床试验中使用最多的病毒载体,分别占到了20.5%和17.9%。慢病毒和AAV 仅占7.3%和7.6%。而近年来,研发人员逐渐意识到腺病毒的高免疫原性引起的过度免疫反应和逆转录病毒整合突变效应潜在的致癌风险,临床试验中更多采用了安全性更好的慢病毒和AAV。AAV更是凭借其安全性好,免疫原性低,体内扩散能力强,能介导基因的长期稳定表达等优点,一跃成为非常欢迎的病毒载体,被广泛应用于体内基因治疗。根据国海证券2020年底的统计,在临床试验使用的病毒载体中,AAV占比超过40%;慢病毒的占比紧随其后,达到30.7%。
除了上述几种常用的病毒载体外,在临床基因治疗中还有牛痘病毒载体、痘病毒载体、单纯性疱疹病毒载体等。
但即便是被广泛认为具有更好的安全性和低免疫原性的AAV载体,也被陆续发现具有安全风险。2018年1月29日,Human Gene Therapy杂志发表了美国宾夕法尼亚大学佩雷尔曼医学院James.M.Wilson教授团队的研究文章,该研究认为静脉高剂量注射AAV病毒用于基因治疗会有严重毒性[1]。
据Audentes Therapeutics报道,2021年9月,安斯泰来的AT132在2/3期试验中累计导致了4名患者因肝脏副作用而死亡。安斯泰来的AT132使用的基因载体正是病毒载体——AAV8。
2021年7月,美国基因疗法公司Adverum Biotechnologies Inc. (NASD-AQ:ADVM,Adverum)暂停了其AAV基因治疗药物ADVM-022用于治疗糖尿病性视网膜病变黄斑水肿(DME)的II期临床试验,原因是一例受试者在接受单次高剂量治疗30周后,出现了眼压过低、炎症以及失明等严重不良反应,引发了业界对该药物安全性的担忧。
病毒载体存在潜在安全性问题,且病毒载体容量有限,这些行业以及研究痛点促进非了病毒载体系统的不断发展。
非病毒载体:利用非病毒的载体材料的物化性质来介导基因的转移,非病毒载体具备无传染性,没有载体容量限制,材料来源广泛,化学结构可控制,且易于大量制备,在表达质粒、反义寡核苷酸或反义表达质粒真核细胞的靶向转移中,有着病毒载体不可替代的作用。常见的非病毒载体有阳离子多聚物载体、脂质体载体、树状聚合物载体和纳米颗粒载体。
与病毒载体相比,非病毒载体具有低成本、易规模化、外源基因长度不受限制、生物安全性更高等优点。在未来的临床应用中非病毒载体能提供更安全的替代方案。非病毒载体虽然有着诸多优点,但也存在着明显的缺点:①转染效率不理想;②外源基因转导到宿主细胞后表达时间短,③非特异性靶向较高等,因此非病毒载体进入临床治疗仍然需要进行技术的优化和革新以确保非病毒系统的稳定性和有效性。
二、人血清白蛋白与重组人血清白
蛋白在基因治疗载体中的应用
01. 作为病毒载体保护剂
逆转录病毒RV和慢病毒LV中脂质包膜的存在降低了它们作为载体的稳定性,同时提高了它们的剪切敏感性,病毒载体的不稳定性会导致此类颗粒面临巨大的产量损失(可高达 70%),同时不能使用除菌过滤的方法也是一个巨大的挑战。
白蛋白常用于病毒载体的稳定剂。使用白蛋白对稳定性差的蛋白、抗体、细胞以及病毒载体进行保护可以避免其在体外失活,被广泛应用于病毒疫苗,细胞治疗等生物制品的研发与生产中间过程,以及药物制剂稳定剂的药用辅料。
另外白蛋白对于病毒载体的功能优化也具有独特的作用。Luis Alfonso Rojas等[2]利用白蛋白与重组腺病毒载体结合,使得该载体在全身给药时免受中和抗体(NAbs)的攻击,使得病毒载体更加高效低敏(图1)同时也降低了腺病毒的细胞毒性。
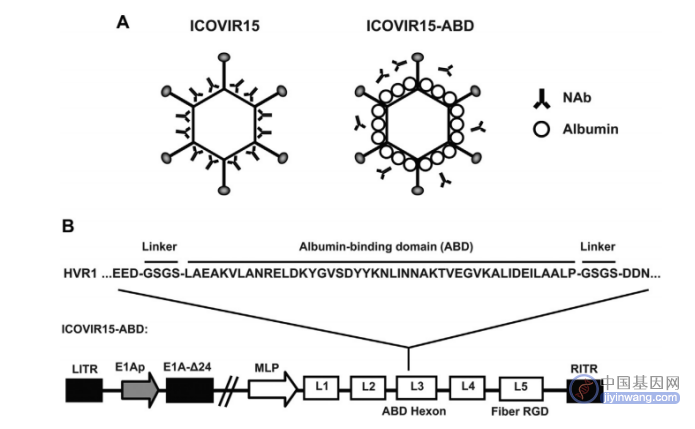
图1:白蛋白-腺病毒整合载体构建[2]
这种白蛋白-病毒的结合载体可改善病毒安全性或许会成为基因治疗领域更有潜力的载体模型。
02. 作为装配非病毒载体的原料
非病毒载体结合DNA分子主要依靠静电相互作用和化学键。形成的载体基 因复合物能够保护DNA分子免受核酸酶降解,并且具有的正电性使复合物体系 保持稳定从而利于细胞内吞作用进行;在进入靶细胞后,复合物以内含体形式存在;随后,该内含体被溶酶体吞噬,为避免外源基因被溶酶体酶降解,要求能够及时有效地从溶酶体内逸出;复合物从内含体释放进入细胞质后释放出DNA;随后,DNA进入细胞核并与染色质基因组重组,使外源基因稳定表达(图2)。
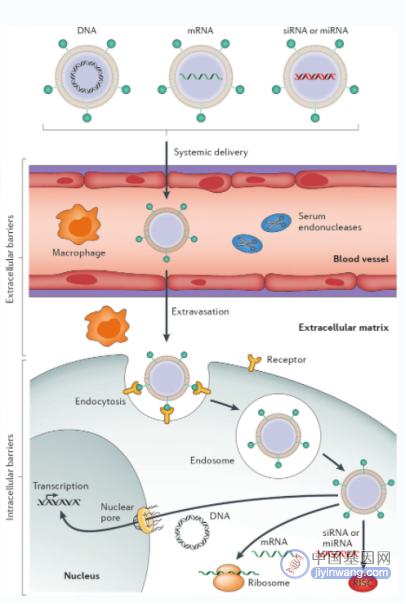
图2:非病毒载体外源基因导入-表达过程[3]
亢晓峰组[4]对人血清白蛋白制备装载DNA的纳米载体进行了构建和测试,结果表明白蛋白纳米管展现了优良的DNA吸附能力,同时在提升离子浓度的条件下白蛋白纳米管可对DNA进行有条件的释放,其研究结果为白蛋白纳米管作为基因治疗的非病毒载体的应用提供了理论基础。
03. 重组血清白蛋白在基因载体中的优势
人血清白蛋白(human serum albu-min HSA)作为人体血液的组成部分之一,本就与人体拥有极好的相容性,同时含有多个药物结合位点,炎症或者肿瘤靶向性,且具有长达19天的半衰期,是非常理想的药物载体。白蛋白载体药物中以2005年上市的紫杉醇白蛋白结合型(Abraxane)最为知名。然而由于天然人血清白蛋白供应不稳定,且含有血液病毒安全隐患,因此白蛋白在基因治疗的应用潜力一直未被彻底开发,针对上述人血清白蛋白的不足之处,武汉禾元生物科技股份有限公司依托专利技术平台——水稻胚乳细胞生物反应器高效重组蛋白表达平台(OryzHiExp)和重组蛋白纯化技术平台(Oryzpur)研发出了植物源重组人血清白蛋白OsrHSA,完全可以替代人血清白蛋白为基因治疗载体提供更安全,供应更有保障的选择。

总结
在基因治疗研究火热的今天,植物源重组人血清白蛋白 OsrHSA 产量稳定成分明确,同时由于植物源重组人血清白蛋白 OsrHSA 具有优秀的相容性,其可以提升病毒载体的稳定性,降低其免疫原性。因此,植物源重组人血清白蛋白 OsrHSA 可成为基因治疗研究的新选择。
参考文献
[1] Christian Hinderer , Nathan Katz, et al. Severe toxicity in nonhuman primates and piglets following high‐dose intravenous administration of an AAV vector expressing human SMN[J]. Hum Gene Ther, 2018;29(3):285-298
[2] Rojas LA, Condezo GN, Moreno R, et al. Albumin-binding adenoviruses circumvent pre-existing neutralizing antibodies upon systemic delivery. J Control Release. 2016;237:78-88.
[3] Yin H, Kanasty RL, Eltoukhy AA, et al. Non-viral vectors for gene-based therapy[J]. Nature Reviews Genetics, 2014,15(8):541-555
[4] 焦培培. 人血清白蛋白纳米管的制备及其对核酸吸附与释放性能的研究[D]. 西北大学, 2015.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。