20年砥砺前行,中国AAV基因疗法即将迈入商业化
细胞与基因治疗无疑是近两年来生物创新药行业热度最高的领域之一,其中,基因疗法作为具有一次性治愈潜力的新型疗法,为许多缺乏有效治疗方案的罕见疾病带来了希望。自2016年至2020年,全球基因治疗市场由0.5亿美元增长到了20.8亿美元,而根据Frost&Sullivan数据与预测,及至2025年,这一市场规模将扩大至305.4亿美元。
目前在研的基因疗法有多种形式,包括溶瘤病毒、CRISPR以及其它编辑工具介导的基因编辑、基于病毒载体的基因补充或外源蛋白表达等。其中,以腺相关病毒(AAV)介导的基因疗法占全球基因治疗临床试验的8.1%,AAV在所有使用病毒和质粒载体的临床试验中占比达到了53%,可以说AAV疗法是目前基因疗法赛道中最重要的方式之一。
AAV在20世纪60年代首次在实验室腺病毒制剂中被发现,1995年实现了在人体中的应用,2008年显示出了临床疗效,在近十年来飞速向前发展。截至目前,全球已有六款AAV疗法获批上市,最早的一款,治疗脂蛋白脂酶缺乏症(LPLD)的Glybera在2012年就获得了EMA(欧洲药监局)的上市许可,而十年后的2022年才被认为是AAV疗法的“收获元年”,因为这一年内便有三款AAV药物相继获批上市。
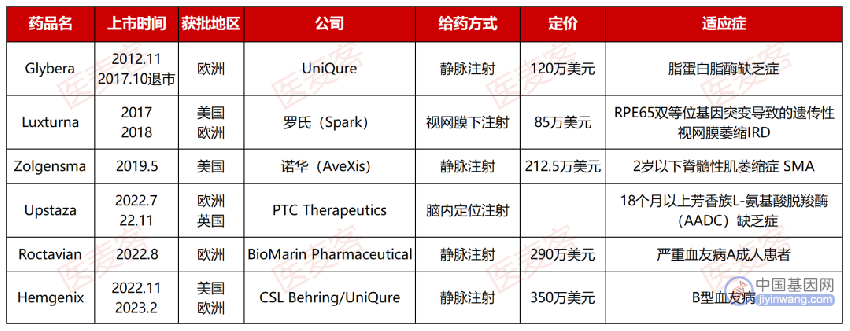
▲ 已上市AAV基因疗法汇总
回看国内行业发展,虽然目前还未有AAV疗法获批上市,但同样在过去的2022年,国内也迎来了爆发式成长,共有13款候选产品获批进入临床,因此,2022年也被称为中国AAV基因疗法的“收获元年”,具有相当大的里程碑意义。回顾AAV基因疗法在国内近20年的发展历程,我们也可以深切地感受到,在监管部门与研发企业的共同努力推进下,我国AAV疗法从0到1、再进入井喷式发展,逐步展现出蓬勃的生命力,并且即将进入商业化时代:
国内AAV疗法发展历程
(政策法规&产品管线)
2003.3
CDE颁布《人基因治疗研究和制剂质量控制技术指导原则》,详细描述了包含AAV载体在内的病毒载体基因导入系统注意事项
2020.9
CDE颁布《基因转导与修饰系统药学研究与评价技术指导原则(征求意见稿)》,对AAV载体的转导风险、包装系统的设计与构建进行阐述
2021.12
CDE颁布《基因治疗产品长期随访临床研究技术指导原则(试行)》,提到了AAV基因治疗长期随访的观察目的和考虑要素
2020.9
纽福斯生物的NR082眼用注射液(rAAV-ND4,NFS-01)获FDA孤儿药认定(ODD),这是首个获FDA 孤儿药认定的中国自研体内基因治疗产品
2021.3
NR082在国内获批IND,成为国内首个获得临床试验许可的体内眼科基因治疗药物
2021.8
信念医药BBM-H901注射液的IND申请获得CDE批准,这是国内首个进入临床的血友病AAV药物,也是国内首个全身给药的罕见病基因疗法
2022.1
纽福斯生物NR082获得FDA授予的IND许可,将在美国开展临床试验,成为首个在美获批临床的国内眼科AAV体内治疗药物,也是首个同时获得中美IND许可的中国籍体内眼科基因治疗产品
2022.4
中国首个LCA基因疗法,朗昇生物的LX101注射液获批临床
2022.6
嘉因生物EXG001-307获批临床,成为国内首款针对I型SMA的自研基因疗法
2022.7
纽福斯生物NR082正式被CDE纳入突破性治疗品种
2022.8
至善唯新的AAV基因疗法ZS801获批临床,这是国内首个B型血友病原创靶标的AAV疗法
2022.9
方拓生物FT-002获批临床,是国内首个获批临床、针对X连锁视网膜色素变性(XLRP)患者的rAAV基因疗法
2022.11
鼎新基因治疗先天性耳聋的AAV基因疗法RRG-003启动IIT,这是国内开展的首个用于治疗耳聋的基因疗法临床探索试验
康弘药业治疗新生血管性(湿性)年龄相关性黄斑变性(nAMD)的AAV基因疗法KH631的IND申请获FDA批准,是国内首款治疗nAMD的AAV候选药物
2023.2
纽福斯生物NR082完成Ⅲ期临床试验所有患者入组,标志着国内AAV基因疗法距离商业化又近了一步
截至目前,国内共有16款AAV疗法候选药物进入了注册性临床,从以上的发展回顾中也可以看出,纽福斯生物的NR082作为研发进展最靠前的一款AAV基因疗法,一直以来也引领了国内这一赛道的多个发展里程碑。而近期纽福斯宣布已完成Ⅲ期临床试验的所有患者入组给药,这也意味着中国的AAV基因疗法即将迈入下一阶段——商业化。
根据Frost&Sullivan预测,中国基因疗法市场规模在2025年将达到25.9亿美元,复合年增长率将达到276%,远超全球市场71.2%的增长率。在基因治疗这一赛道上,中国的研发起步虽晚于全球,但其发展却相当迅速。
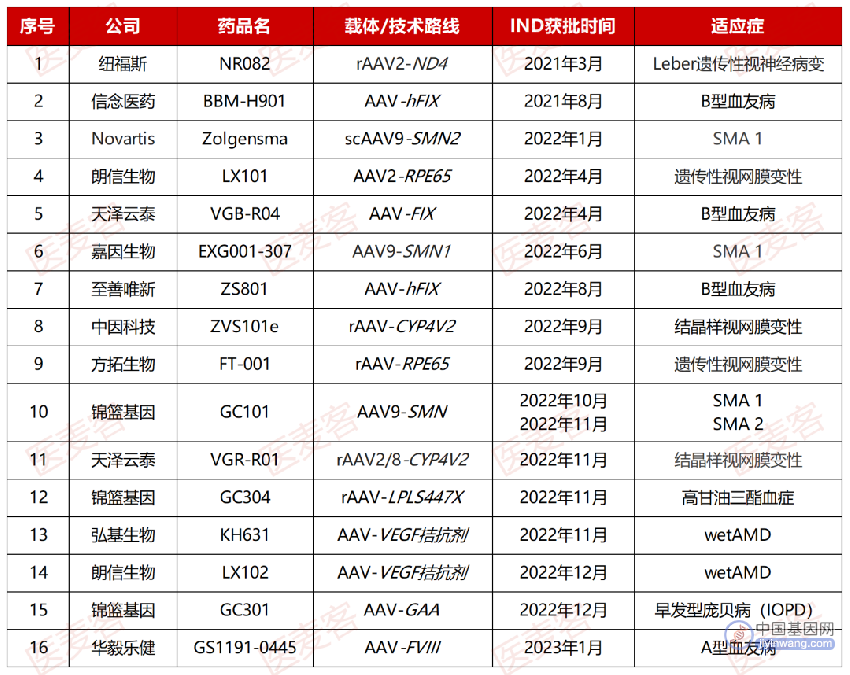
▲ 国内获批临床的AAV疗法
纽福斯的NR082眼用注射液是一款基于rAAV2的基因疗法,用于治疗ND4突变引起的Leber遗传性视神经病变(ND4-LHON),通过玻璃体腔注射将正确的基因递送至患者受损的视神经节细胞,以修复线粒体生物呼吸链,使视神经节细胞恢复活力与视功能。
从临床注册时间上看,虽然这款候选药物在2021年3月才正式获批国内的临床试验申请,但实际上公司的创始人李斌教授及其带领的团队早在2011年就发起了全球首例LHON基因治疗的IIT1研究,并于2017年启动了全球样本量最大的国际多中心IIT2研究。正是这历经十余年的漫长开发与数据积累,现在可以为该款AAV疗法提供全球最长随访时间(90个月)与最大样本量(186例)的安全性和有效性数据,这不仅为注册性临床的快速推进奠定了坚实的基础,同时也间接推动了药物的产业化落地。
在NR082获批国内临床1年多时间,2022年5月,纽福斯Ⅰ/Ⅱ期临床试验进展顺利,并与CDE进行沟通,就Ⅲ期临床方案可行性达成一致意见。2022年9月,纽福斯正式启动了Ⅲ期临床试验,并在短短5个月内完成了Ⅲ期临床试验所有患者入组给药。除了长期且大量的早期临床经验之外,也可以从侧面看出纽福斯在管理上的成功。
LHON是世界上最常见的青壮年致盲性疾病之一,多发于14-21岁的青年男性,其中ND4突变约占50%~80%,目前临床上尚无针对该病的有效治疗手段。针对这一罕见眼科疾病,除NR082外,纽福斯还有一款候选疗法NFS-02已于去年年底获得FDA的临床试验许可,用于治疗ND1突变引起的LHON,目前正在准备国内IND申报。
从公司管线的推进来看,NR082作为核心管线一直以来都是公司重点的推进项目,可是说是非常聚集与专注。随着首条管线逐渐走向成熟,纽福斯已经在苏州建立了自己的商业化生产基地,占地约8000㎡,符合中、美、欧三地GMP标准,可满足产品的全球商业化需求。
从2016年公司成立至今,纽福斯凭借稳健且高效的产品研发,率先引领中国的AAV眼科基因治疗产品一步步走向全球、走向商业化。或许在不久的将来,纽福斯将改变目前LHON无药可治的局面,填补这一全球市场的空白!
小结
自我国第一部涉及到AAV疗法的政策法规颁布至今已过去20年,尽管稍落后于国际领先水平,但2021年国内致力于基因疗法的首批企业开始申报临床,2022年有13款AAV基因疗法获批IND,在2023年开年,进展最快的药物已完成Ⅲ期临床患者入组,砥砺发展二十年的AAV基因疗法终于走到了商业化前夕。就我国基因疗法发展的趋势来看,未来几年将继续呈现高速发展,并构建出多样化、差异化的发展格局。
下一个里程碑,让我们一起期待!
参考资料:
1.http://legacy.frostchina.com
2.http://cjpi.org.cn
3.各公司官网
注:本文所涉及的AAV基因疗法特指以AAV为载体的基因替代疗法。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。