世界首个基因编辑疗法有望年底获批,它能改写百万患者命运吗
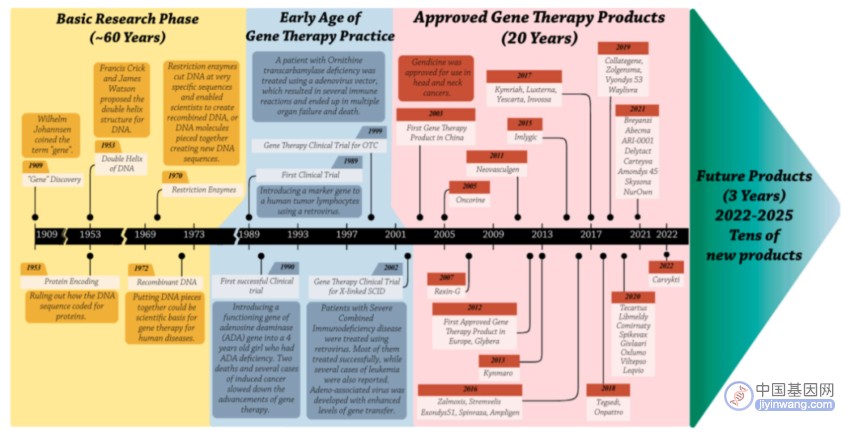
最近,美国食品药品监督管理局批准全球首个体内基因编辑疗法NTLA-2001开展Ⅲ期临床试验。年底,世界首个CRISPR基因编辑疗法exa-cel有望获批上市。一个个突破性进展,预示着“基因编辑疗法时代”即将到来。
2012年诞生、2020年获得诺贝尔化学奖,基因编辑技术CRISPR正给医学带来划时代改变。这种被誉为“基因魔剪”的基因编辑工具将可用于治疗从罕见遗传疾病到癌症、高胆固醇血症、不孕症等疾病,改写数以百万计患者的人生。
——编者
“自出生就注定要忍受这种痛苦,我觉得这样的人生不值得再继续下去。”从有记忆起,维多利亚·格雷就一直承受着遗传疾病所带来的病痛折磨。她的祖母只能尝试用热毛巾和药物来缓解一阵又一阵令格雷痛不欲生的剧痛,尽管这些都是徒劳。
格雷患的是一种被称为“镰刀状细胞贫血病”的遗传性疾病,患者成年后体内产生的红细胞不是正常的圆盘形,而是类似镰刀的异常形状,从而阻塞毛细血管、导致疼痛,有时还会造成器官损伤。
年岁渐长,格雷的疼痛也越来越严重。有一次,她的手臂和腿部暂时失去了知觉。30多岁时,她不得不依靠专门的家庭护理来照顾。为了改变命运,她在4年前成为了第一个接受实验性CRISPR基因编辑疗法的患者。在接受治疗4年后,格雷与生俱来的疼痛不再发作,并能与其他正常人一样生活,“现在我对生活充满了希望”。
据悉,该疗法可能很快将获得美国、英国和欧洲监管机构的批准,成为世界上首个获批的CRISPR基因编辑疗法。
这是CRISPR基因编辑疗法首次获得成功应用。未来,这种“基因剪刀”可以用来治疗,甚至治愈各种疾病。但目前,它还是一种稀罕的昂贵疗法,只有少数人承担得起。在攻克人类疑难疾病的路程上,这种突破性疗法究竟能走多远?
医学应用迅速
已有上百项临床试验
2012年,科学家有了一个重大发现:许多细菌产生的CRISPR-Cas蛋白,可在特定位置切割DNA,但每种蛋白质只能与某个特定序列的DNA结合并对其进行切割。生物学家必须针对不同序列的DNA,改变CRISPR-Cas蛋白与DNA结合部位的形状,但这是一个相当困难且昂贵的过程,往往需要耗费数月时间。
后来,科学家又发现,CRISPRCas蛋白的目标序列是由一段“向导RNA”决定的,它可与Cas蛋白连接,并与任何匹配的DNA序列结合在一起。由于向导RNA既便宜又容易制造,这就突破了DNA切割困难且昂贵的条件限制,使得CRISPR基因编辑技术飞速发展。短短几个月内,世界各地数百个实验室对各种有机体进行了CRISPR基因编辑的实验和研究,将它用于检测病毒、记录细胞活动等。
基因编辑技术很快成为生命科学、医学等领域最耀眼、最有前景的技术之一。目前,全球有上百项涉及CRISPR基因编辑的临床试验正在进行或已完成。“不久的将来,基因编辑疗法将改变我们的生活,让人们生活得更健康,活得更长久。”美国斯坦福大学生物伦理学家凯利·奥蒙德说道。
在这些基因疗法临床试验中,约一半与癌症治疗有关。研究者通常先取出癌症患者体内的免疫细胞进行基因编辑,使其获得抵御癌细胞的强大能力,然后再将它们送回患者体内。
此外,大多数CRISPR临床试验与治疗遗传性疾病相关,如镰刀状细胞贫血病。这种疾病是由成人血红蛋白(血液中携带氧气的蛋白质)基因的两份拷贝发生突变引起的。但也有一些同时携带两份拷贝基因突变的人并不会生病,因为他们从儿童期到成年期都在不断产生胎儿血红蛋白,而不是像其他人一样出生后就停止产生。研究人员由此得到启发,是否可以利用CRISPR基因编辑技术重新激活产生胎儿血红蛋白,从而治疗镰刀状细胞贫血病呢?
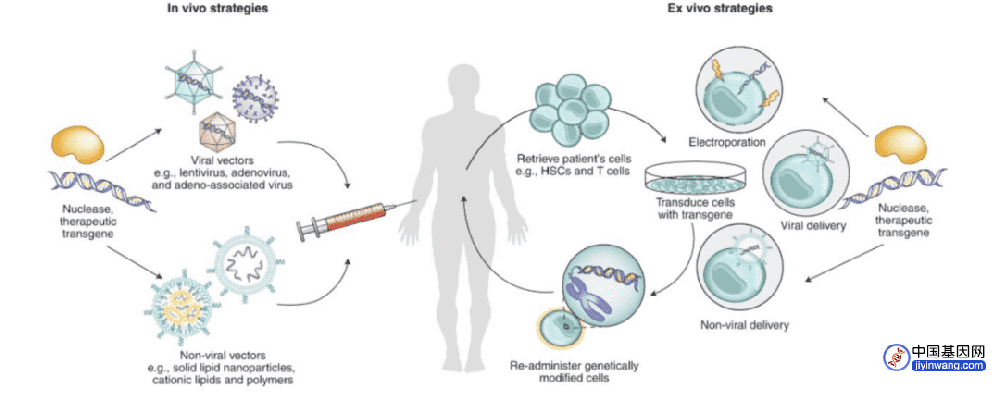
维多利亚·格雷的治愈就是基于这一理念。医生首先从格雷体内提取产生血红细胞的造血干细胞,然后使用CRISPR技术和一种名为Cas9的酶来破坏产生胎儿血红蛋白基因的“关闭开关”,接下来再利用化疗技术杀死格雷骨髓中之前未修改的造血干细胞以腾出空间,最后将基因编辑后的造血干细胞输回患者体内。
由美国波士顿Vertex制药公司开发的这一基因编辑疗法还可用于治疗乙型地中海贫血,这种血液疾病也是由血红蛋白突变引起的。目前已有48人接受了治疗,在27名长期随访患者中,24人至少一年内不再需要输血,另外3人也只需少量输血即可。
碱基编辑更安全
变“删单词”为“改字母”
即将获批的CRISPR基因疗法将是医学上的一个重大里程碑,但它存在一个重大问题,限制了其未来的广泛应用。严格说来,这是一种靶向的基因摧毁,而非真正的基因编辑。
美国哈佛大学学者理查德·刘指出,Cas9蛋白的DNA切割位点是由向导RNA决定的,然后细胞修复系统开始将割裂的两端“缝合”起来。但接下来Cas9会对DNA进行反复切割,直至出错,产生使基因失效的突变。
这相当于划掉整个单词,而不是只划掉拼写出错的某个字母来纠正文本错误。在少数情况下,这种方法是好用的,比如句子中多了一个不该出现的单词,但对大多数拼写错误来说,不能采取这种方法修正。同样道理,治疗大多数遗传疾病需要的是对基因进行修正,而不是破坏整个基因。而且完全切断DNA还会存在安全问题,多次切割可能会导致末端连接出错。
好消息是,目前已有多种方案可解决这一问题。其中,最有希望获得广泛应用的是CRISPR碱基编辑,它将4个组成DNA的字母(A、G、T、C)中的一个直接转化为另一个,而不进行任何切割。
通过将CRISPR-Cas9蛋白的切割部分替换为一种通过化学方法改变单个基因“字母”的酶,理查德·刘创造了第一个碱基编辑器。更多的碱基编辑器仍在开发和改进中,现有编辑器已经孕育出了一些治疗方法,尽管还在研发中,但目前至少已挽救了一条生命。
去年,一位名叫艾莉莎的白血病女孩在所有常规治疗方法尽皆无效之后,她的医生转而尝试了新的实验性方法。由于她患的是T细胞白血病,因此通常通过改造T细胞来成为某类特定癌细胞“狙击手”的CAR-T细胞疗法,无法在她身上起效,因为这会使用于治疗的T细胞自相残杀。
因此,除了添加靶向基因外,研究人员瓦西姆·卡西姆还利用碱基编辑技术来阻止CAR-T细胞之间的相互误杀。卡西姆通过碱基编辑一共做了4种基因修改来改善艾莉莎的细胞功能。接受碱基编辑CAR-T细胞治疗后不久,艾莉莎体内就检测不到癌细胞了。

降低治疗成本
探索基因编辑细胞“成品”
虽然碱基编辑技术比一般的CRISPR编辑工具更强大、更安全,但它的作用比较单一,只限于对单个DNA字母的修改。于是,理查德·刘的同事安德鲁·安扎隆开发了一种新的编辑工具——引导编辑系统。
这种工具可以多种方式对Cas9蛋白进行修改,能够在基因组的靶位点处实现任意碱基替换和小片段精准删除和插入。它们不会直接切割DNA,而是“切割”构成双螺旋两条链中的一条。这一基因修改工具可添加或删除大约40个字母的DNA短片断。理查德·刘说,这一基因工具可用来治疗95%的遗传性疾病。
但生物学家并未满足于此。发表于2022年的研究报告称,利用改良后的引导编辑系统,研究人员在特定位点上成功添加了长达3.6万个碱基的DNA片段。所有这些表明,我们已经拥有了一系列正在迅速发展的、能够真正进行基因编辑的CRISPR工具。
眼下,基因编辑疗法还存在一个重要问题——成本高昂。在正式获得上市批准之前,Vertex尚未宣布基因编辑疗法治疗镰刀状细胞贫血病的费用,但其他一些罕见疾病的基因疗法成本和治疗费用都高达数百万美元。镰刀状细胞贫血病困扰着全球数百万患者,格雷的家族中还有好几位仍在经历这种疾病的折磨,他们最大的忧虑就是无法承担昂贵的治疗费用。
降低成本的方法之一是从单一捐赠者身上提取细胞进行编辑,再供多位不同患者使用。这种基因修改细胞“成品”已被用于癌症治疗,如艾莉莎接受的白血病基因编辑疗法。由于白血病患者的免疫系统很弱,基本上不会有对外来供体细胞产生排斥反应的问题。治疗成功后,患者的免疫系统得到恢复,供体T细胞就会被杀死,但此时它们的使命已经完成,所以不会成为一个问题。
一家公司正在尝试编辑删除供体细胞上的“外来细胞”蛋白质标记,这意味着它们可以在受体体内无限期地存在而不会引发排斥反应。这一研究的目标是用来治疗癌症以外的其他疾病,比如1型糖尿病。
与从患者自身体内提取和改造细胞相比,备用成品细胞可大大降低成本,但任何基于细胞的基因疗法仍会相当昂贵,因为体外细胞的培养和维护、确保其纯度和安全性等环节的成本依然很高。
>>>延伸阅读
明星疗法也有禁区
随着基因编辑疗法即将获批,更多基因治疗技术也在加紧研发。一个新的问题随之产生:我们是否应该对胚胎、卵子和精子的基因组进行编辑,从而改变后代所有细胞的DNA,并让这些改变世代传递下去呢?
就目前来说,没有令人信服的理由必须这么做。如今几乎所有的遗传疾病都可通过现有筛查技术来预防,包括在胚胎植入前对体外受精胚胎进行检测。相比之下,使用CRISPR技术对胚胎和生殖细胞进行基因编辑是有相当风险的,因为它不能保证可以修复体内所有细胞的致病突变,而且可能会有引入危险突变的风险。因此,该领域所有专家一致认为,目前任何人都不应尝试进行胚胎与生殖细胞的基因编辑。
但是,利用CRISPR基因编辑技术治疗因精子干细胞突变导致的不育症是可能的。有学者指出,试管婴儿产生的胚胎有时很少,在筛选致病突变的过程中,也会使试管婴儿的成功率大大降低。因此,如果遗传基因组编辑的安全性可以得到保证,那么在这种情况下对胚胎进行基因编辑或许比完全舍弃这种方法更好。但最终能否施行,仍要通过生命伦理的相关评估与审核。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。