张锋Nature新作:借助AlphaFold,或将改写基因治疗

如果把细胞比作是精密的机械钟表,那么蛋白质就是其内部大大小小的齿轮,它们是生命活动的主要执行者,发挥着生命基石般的关键作用。而蛋白质结构是其功能的基础,如果我们能任意改造蛋白质结构,那么就能自由控制其功能,其潜在应用无疑非常巨大。
要想实现这一点,准确预测或解析蛋白质的三维空间构象是关键第一步。在过去,想要确定蛋白质结构不仅困难而且耗时耗力。而随着人工智能(AI)技术的发展,DeepMind公司开发的AlphaFold,能够仅依据蛋白质序列信息,就能快速准确预测蛋白质三维结构,其强大的能力受到越来越多的关注和应用。
2023年3月29日,CRISPR基因编辑先驱张锋教授及其团队在 Natrue 期刊发表了题为:Programmable protein delivery with a bacterial contractile injection system 的研究论文。
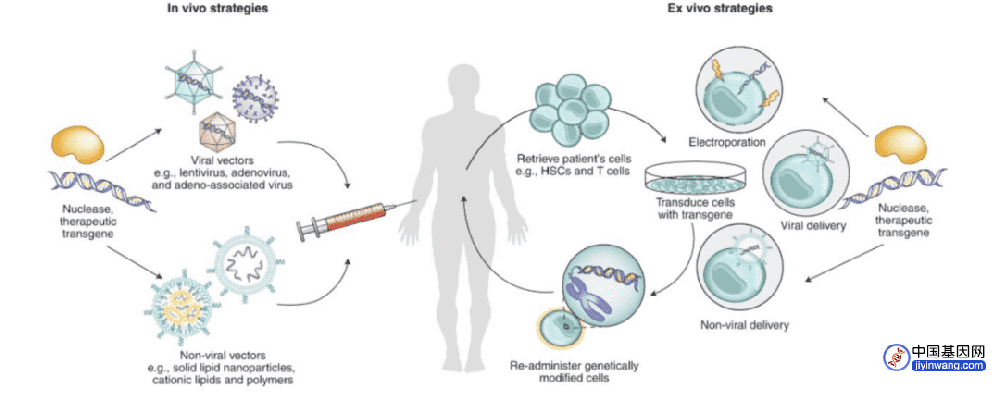
在这项最新研究中,张锋团队通过AlphaFold辅助蛋白质设计开发了一种蛋白质递送系统——改造、利用独特的细菌“注射器”将蛋白质注射到人类细胞中。这种新型蛋白质递送方式或将改变基因治疗、癌症治疗等前沿疗法格局,具有强大的应用前景。

内共生细菌是一类特殊的细菌,它们可以寄生在宿主细胞的内部,并已然进化出复杂的传递系统使其分泌调节宿主细胞的生物因子。例如,细胞外可收缩注射系统(eCIS),正是这样一种类似于“注射器”的大分子复合物。eCIS通过驱动一个“针头”结构穿透细胞膜,然后将携带的蛋白质有效载荷注入到真核细胞中。
eCIS广泛分布在细菌和古菌中,并已被证明具有多种天然功能,包括调节宿主细胞骨架、DNA切割,诱导变形运动和产生宿主毒性。最近,有研究发现eCIS可以靶向小鼠细胞,这就提高了eCIS作为蛋白质递送工具的可能性。
然而,eCIS的活性尚未在人类细胞中得到证实,如果想要将eCIS开发为靶向递送系统,就要先阐明eCIS识别靶细胞的机制。
在这项最新研究中,张锋团队首先选定了eCIS的一个亚型——Photorhabdus virulence cassette(PVC)。PVC由一个约20kb的操纵子组成,包含16个核心基因(pvc1-16),以及下游的有效载荷Pdp1和Pnf。研究团队发现,PVC有效载荷蛋白的N端高度无序区域是其“包装结构域”,只要将其与想要递送的蛋白(例如GFP)融合,就能将其加载到PVC复合体中。
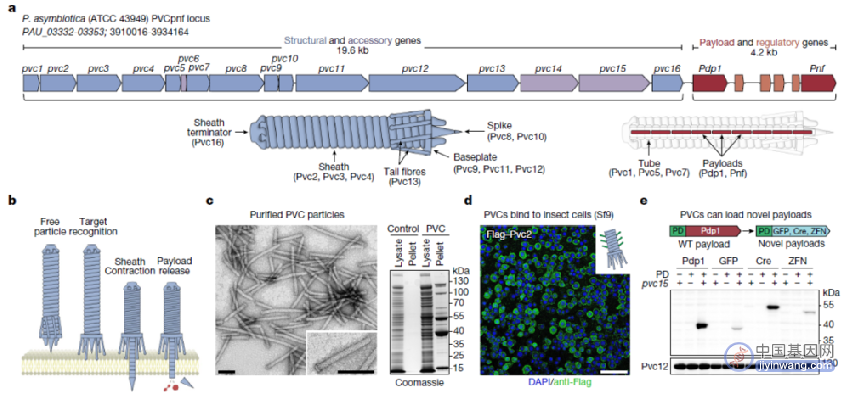
PVC系统可以被重新编程以在真核细胞中定制蛋白递送
值得注意的是,除了N端高度无序区域之外,Pvc13(尾纤维蛋白)和Pvc15(一种ATP酶)也是该递送系统成功的关键。其中,Pvc13可能参与了PVC复合体的靶标识别,并可用于操纵PVC复合体的靶标特异性。
基于此,研究团队使用AlphaFold预测Pvc13的三维结构,当将其作为三聚体时,Pvc13的C端形成了一个预测的螺旋管结构和一个球状的尖端结合结构域。研究团队由此假设,改变Pvc13的这个尖端结合域的结构特征可能会导致PVC的靶向性发生可预测的变化。
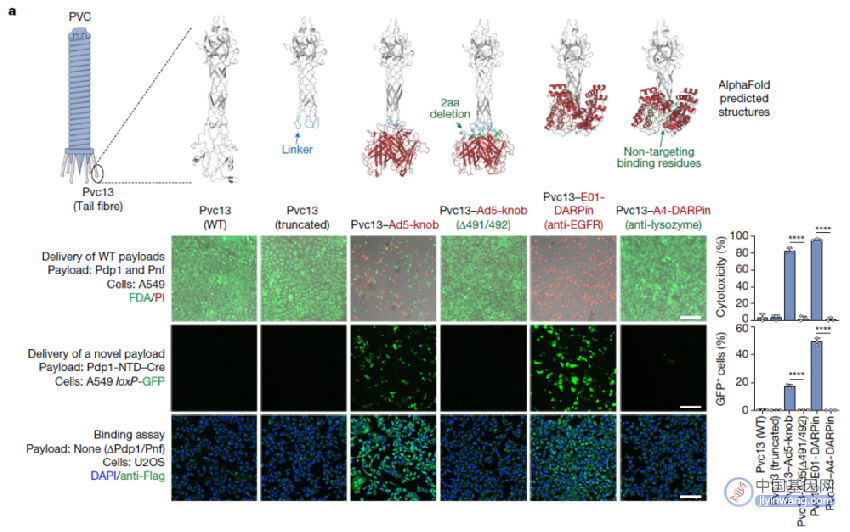
AlphaFold预测和改造Pvc13,以改变PVC系统的宿主细胞靶向性
为了验证这一点,研究团队将针对人类细胞的结合结构域(Ad5-knob和E01-DARPin)插入到Pvc13的C端结合域,并测试由此产生的PVC复合体是否可以靶向人类细胞。结果显示,改造后的PVC可以有效杀死A549细胞(携带毒性基因)或高效表达GFP(融合蛋白)。
这些结果表明,Pvc13是PVC复合体的一个靶向性决定元件,该蛋白可以被修饰,从而靶向特定的细胞系。
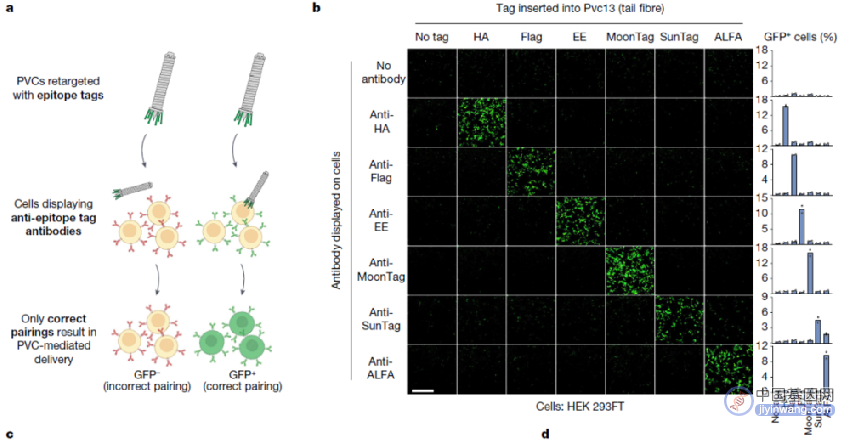
PVC介导的蛋白递送具有高度特异性
进一步研究显示,改造后的PVC复合体还可以自由装载spCas9、锌指脱氨酶(ZFD)以及细胞毒素等不同的效应元件,前两者分别实现对靶细胞DNA的基因编辑和不依赖RNA的基因编辑,后者则可以靶向清除癌细胞、衰老细胞等有害细胞。
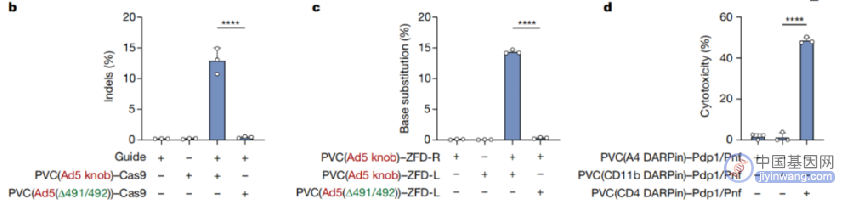
改造后的PVC系统可以靶向递送多种效应元件
不仅如此,为了验证PVC递送系统在活体动物中的效果,张锋团队再次使用AlphaFold引导Pvc13的工程化设计,并筛选到两种靶向小鼠细胞的PVC系统——Pcc-13-Ad5-knob(RGD/PK7)和Pvc13-Anti-MHCII Nb。与预期一致,前者表现出较为广泛的趋向性(正如Ad5 RGD/PK7病毒感染那样),而后者则对MHC+免疫细胞表现出强烈的偏好性。
张锋团队还发现,PVC治疗没有产生任何显著的免疫细胞激活、炎症细胞因子产生、体重损失或细胞毒性,这表明PVC治疗在实验过程中没有产生免疫原性或毒性。此外,PVC治疗七天后就无法从小鼠大脑中检测到PVC相关蛋白,这表明PVC递送系统仅在大脑中短暂停留,不会持续太长时间。
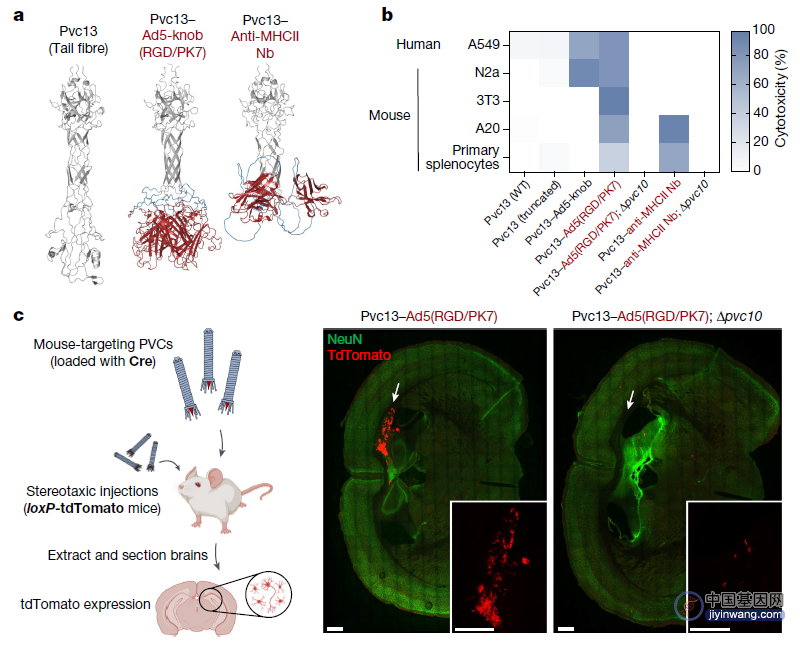
重编程的PVC系统在小鼠体内实现靶向递送
总的来说,这些结果表明,PVC系统经过改造后可以在细胞和体内靶向递送蛋白质,并在基因编辑、癌症治疗和临床靶向递送等领域展现出广阔的应用前景,未来可能成为许多生物疗法的关键递送工具。
论文链接:https://www.nature.com/articles/s41586-023-05870-7
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。