Cancer Discovery:靶向最强癌基因KRAS的G12D突变的小分子药物诞生!
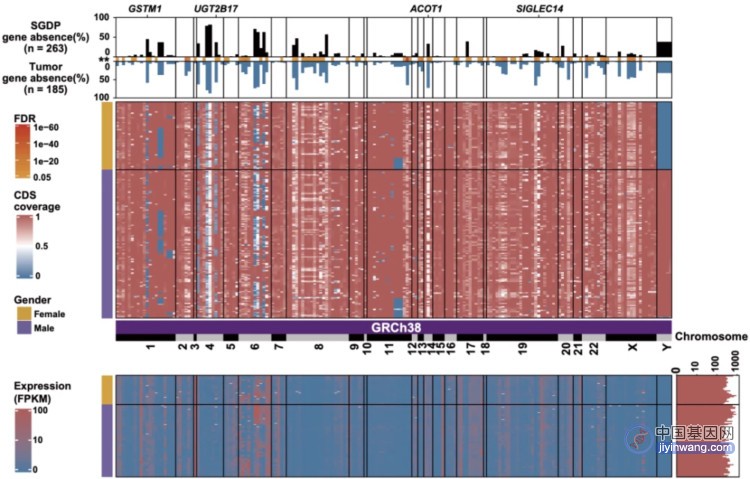
KRAS基因是肿瘤中最常突变的癌基因之一,在多种类型的恶性肿瘤中均可检测到,普遍存在于胰腺癌(86%)、结直肠癌(41%)、肺癌(32%)中[1]。但是由于KRAS突变基因缺乏疏水口袋,难以与小分子结合,既往一直被视作“难以成药”靶点。
虽然针对KRAS的药物研发充满荆棘,但过去30多年中,针对KRAS突变肿瘤药物研发的探索却从未停止。Sotorasib及Adagrasib作为靶向KRAS-G12C突变的药物,在非小细胞肺癌(NSCLC)患者中取得可喜的疗效,先后于2021年及近期被FDA加速批准上市[2,3]。这也为靶向不同类型KRAS突变基因药物研发带来新的启发和动力。
近日,来自美国宾夕法尼亚大学的Ben Z. Stanger及Robert H. Vonderheide教授团队在Cancer Discovery杂志上发表重要研究成果。结果表明,新型小分子KRAS-G12D抑制剂MRTX1133能够显著抑制该位点突变的胰腺癌肿瘤生长,并且重塑肿瘤微环境,或为胰腺癌患者治疗带来曙光。

(文章封面)
胰腺导管腺癌(PDAC)是一种恶性程度极高的肿瘤类型,其5年生存期仅有11%[4],素有“癌王”之称。目前对于胰腺癌的治疗手段仍然十分有限,胰腺癌也成为科学家们积极攻克的方向。
由于胰腺癌肿瘤中有超过90%的患者存在KRAS突变,KRAS突变蛋白成为胰腺癌中十分有前景的治疗靶点。不同于NSCLC中大部分为KRAS-G12C突变,胰腺癌中KRAS-G12C突变只有不到1%,大部分为G12D突变[1]。同样是KRAS基因突变,虽然只有一个字母之差,但是相关药物对肿瘤的效果却大相径庭。
今年早些时候,MRTX1133的临床前研究结果发表于Nature Medicine杂志上[5]。相关结果表明MRTX1133能选择性与KRAS-G12D突变体结合,在多种携带KRAS-G12D突变的肿瘤细胞系中均显示出特异性抑制KRAS依赖的相关信号通路,并且MRTX1133和EGFR单抗西妥昔单抗联合用药相比于单药能够抑制肿瘤细胞pERK和pS6的表达,显著提高抗肿瘤效应[5]。
本研究中,研究人员探究了MRTX1133在胰腺癌中的疗效以及对肿瘤微环境的影响。
首先,研究人员在体外细胞实验中验证了MRTX1133的特异性和效力。在KRAS-G12D突变的人类和小鼠胰腺癌中,MRTX1133的IC50值显著低于KRAS野生型和其他类型突变(图1),证明MRTX1133对KRAS-G12D突变有较好的选择性。
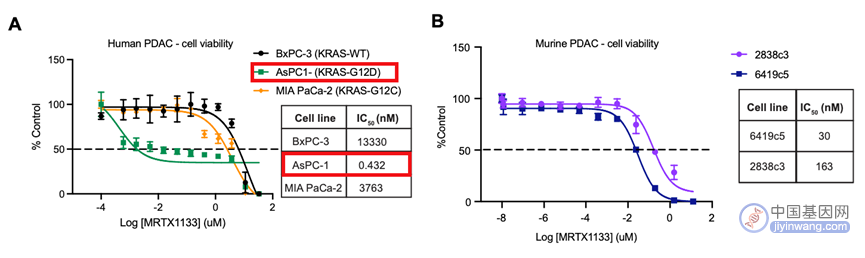
(图1 MRTX1133选择性抑制KRAS-G12D突变)
然后,研究人员探究了MRTX1133对免疫功能完善的PDAC种植瘤模型的疗效。利用两株具有KRAS-G12D突变背景的鼠源PDAC细胞系,结果表明,无论是皮下瘤还是原位种植肿瘤,MRTX1133均显示出对肿瘤显著的抑制效应(图2)。
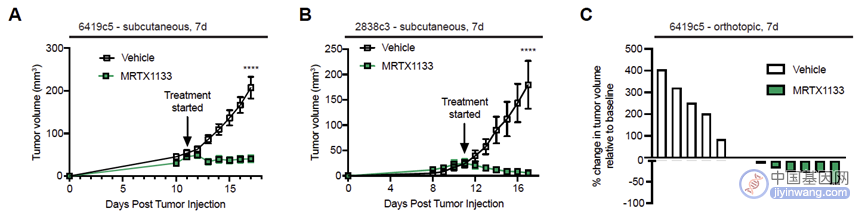
(图2 MRTX1133显著抑制PDAC种植瘤生长)
同时,由于转移是导致胰腺癌预后较差的主要原因,研究人员还利用转移小鼠模型,发现MRTX1133能够显著抑制PDAC细胞系的肺转移(图3)。
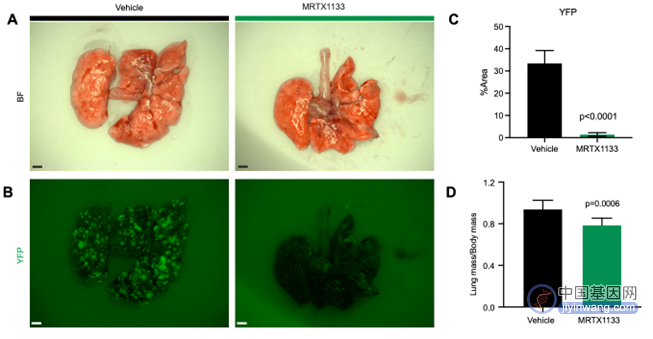
(图3 MRTX1133显著抑制PDAC肺转移)
接着,通过免疫荧光染色,研究人员还发现MRTX1133治疗后,皮下瘤及原位瘤模型中的肿瘤相关成纤维细胞(myCAF)的标志物α-SMA以及血管内皮细胞的标志物EMCN显著升高(图4),提示MRTX1133对于KRAS-G12D突变PDAC肿瘤基质以及血管生成有显著的调节作用,而既往研究表明myCAF可能参与抑制胰腺癌肿瘤生长,这可能是MRTX1133发挥作用的机制之一。
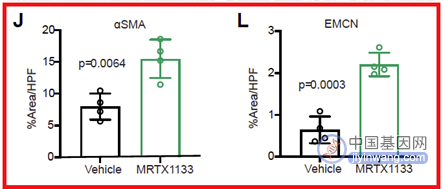
(图4 MRTX1133对种植瘤基质及血管生成的影响)
由于研究者使用免疫功能完善的小鼠肿瘤模型,使得进一步探究MRTX1133对肿瘤免疫微环境的影响成为可能。
通过流式细胞术,研究人员发现该药物能够导致肿瘤微环境(TME)发生显著变化,其中巨噬细胞在MRTX1133治疗后显著升高并且向M1型巨噬细胞转换。同时,MRTX1133治疗后髓源性抑制细胞(MDSCs)显著减少,而CD4+T细胞及细胞毒性CD8+T细胞显著升高(图5)。
以上结果提示,抑制KRAS-G12D突变蛋白后增强了细胞毒性T细胞对肿瘤细胞的杀伤作用。
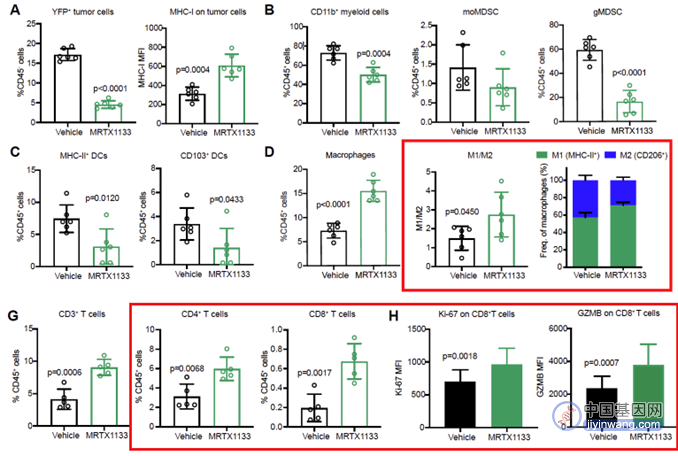
(图5 MRTX1133对PDAC免疫微环境的影响)
基于以上结果,为探究T细胞究竟在MRTX1133抗肿瘤作用中起到怎样的作用,研究人员在使用MRTX1133时联用CD4/CD8的抗体从而达到耗竭T细胞的作用。结果表明,单独使用MRTX1133治疗显著抑制了肿瘤生长(100%),而联用MRTX1133和CD4/CD8抗体组中虽然也表现出显著的肿瘤抑制作用(86%),但是并没有一例达到完全缓解(CR,图6)。
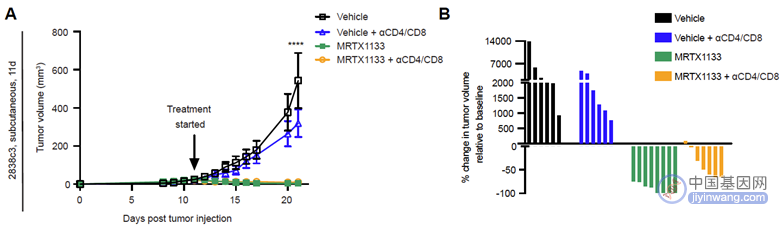
(图6 皮下瘤小鼠模型)
接着研究人员更进一步探究T细胞在停用MRTX1133是否仍然发挥着抗肿瘤作用。结果表明,当用药14天停药后,联用MRTX1133和CD4/CD8抗体组肿瘤复发,而单药MRTX1133组中有50%(4/8)肿瘤仍处于缓解状态,没有可检测到的肿瘤细胞,另外的50%(4/8)也只属于有限的肿瘤再生。
这些结果表明,肿瘤对MRTX1133的响应不依赖T细胞,但T细胞可以增强肿瘤对药物响应后持续效果,并且有助于抑制药物初始发挥疗效后的肿瘤再生。
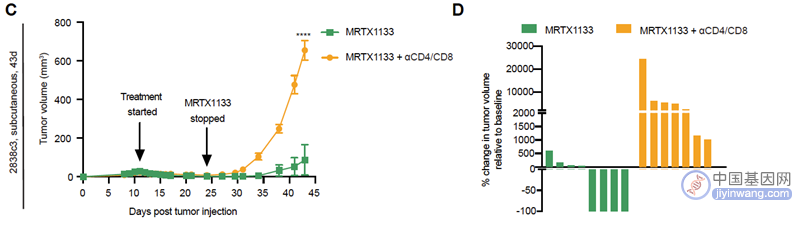
(图7 皮下瘤小鼠模型)
最后,为了更加全面论证MRTX1133对KRAS-G12D突变的PDAC具有良好的肿瘤抑制作用,研究人员还使用了携带KRAS-G12D突变的原发性PDAC小鼠模型(KPC/Y),结果同样表明该药物对肿瘤有良好的抑制作用(图8)。
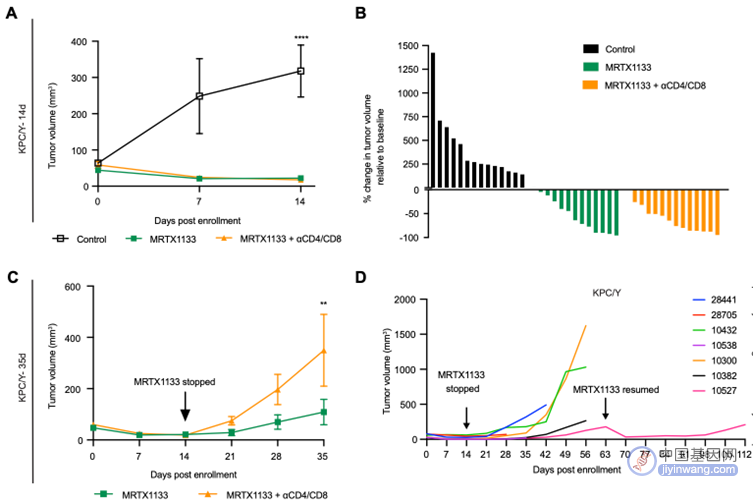
(图8 KPC/Y原发性PDAC肿瘤小鼠模型)
总结一下,无论是种植瘤还是原发模型,MRTX1133均显示出对KRAS-G12D突变的PDAC良好的肿瘤抑制作用,并且MRTX1133参与对肿瘤免疫微环境的重塑,或可与免疫治疗发挥协同作用。
2021年,第一款靶向KRAS突变位点的药物Sotorasib被FDA加速批准上市,一举打破了既往认为KRAS“难以成药”的魔咒,随即各大制药公司的相关药物也纷纷进入临床试验。令人欣喜的是,本研究中MRTX1133小分子的问世,标志着KRAS另一更常见的突变位点G12D或将有药可用。
目前关于KRAS-G12D突变的实体瘤尚无标准靶向治疗方案,在胰腺癌领域,化疗及免疫治疗等也并未取得预期的疗效。对于KRAS-G12D突变的实体瘤,尤其是恶性程度极高的胰腺癌,仍然有迫切的临床治疗需求未被满足。
本研究作为临床前研究,距离批准MRTX1133上市用于肿瘤患者的治疗估计仍有一段距离,不过我们有理由感到欣喜,目前研究数据已经显示出良好的治疗效果。对于携带KRAS-G12D突变的实体瘤患者,尤其是胰腺癌患者,或许癌症成为慢性病管理的愿景正在一步步实现!
参考资料:
1. Moore AR, Rosenberg SC, McCormick F, Malek S. RAS-targeted therapies: is the undruggable drugged? [published correction appears in Nat Rev Drug Discov. 2020 Dec;19(12):902]. Nat Rev Drug Discov. 2020;19(8):533-552. doi:10.1038/s41573-020-0068-6
2. Skoulidis F, Li BT, Dy GK, et al. Sotorasib for Lung Cancers with KRAS p.G12C Mutation. N Engl J Med. 2021;384(25):2371-2381. doi:10.1056/NEJMoa2103695
3. FDA grants accelerated approval to adagrasib for KRAS G12C-mutated NSCLC. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-adagrasib-kras-g12c-mutated-nsclc
4. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72(1):7-33. doi:10.3322/caac.21708
5. Hallin J, Bowcut V, Calinisan A, et al. Anti-tumor efficacy of a potent and selective non-covalent KRASG12D inhibitor. Nat Med. 2022;28(10):2171-2182. doi:10.1038/s41591-022-02007-7
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。