从遗传学角度,基因检测在卵巢癌预防和治疗中的作用
美国著名影星安吉丽娜·朱莉于2013年5月撰文《我的医疗选择》,宣称通过基因检测,确定自己携带BRCA1突变,医生估计其将来患乳腺癌和卵巢癌的风险颇高。
为降低患癌风险,她选择保留乳房的双侧乳腺切除术,并于2015年宣布在腹腔镜下实施双侧输卵管卵巢切除术。

报道一出,世界哗然,并引发了公共卫生界的“朱莉效应”,即接受基因检测的女性转诊量明显上升,发现携带BRCA突变的女性的数量也明显上升。
遗传咨询和遗传检测在预防卵巢癌中的重要作用已经被NCCN指南所认可,通过对包含BRCA1/2基因在内的卵巢癌遗传易感基因进行突变检测,可以预测咨询对象卵巢癌的发病风险,帮助医生做出正确及时的患者管理。另一方面,包含BRCA基因检测在内的HRD检测也能用于指导临床用药,为卵巢癌患者开启PARP抑制剂维持治疗提供依据。
BRCA基因是遗传性卵巢癌遗传检测的重中之重
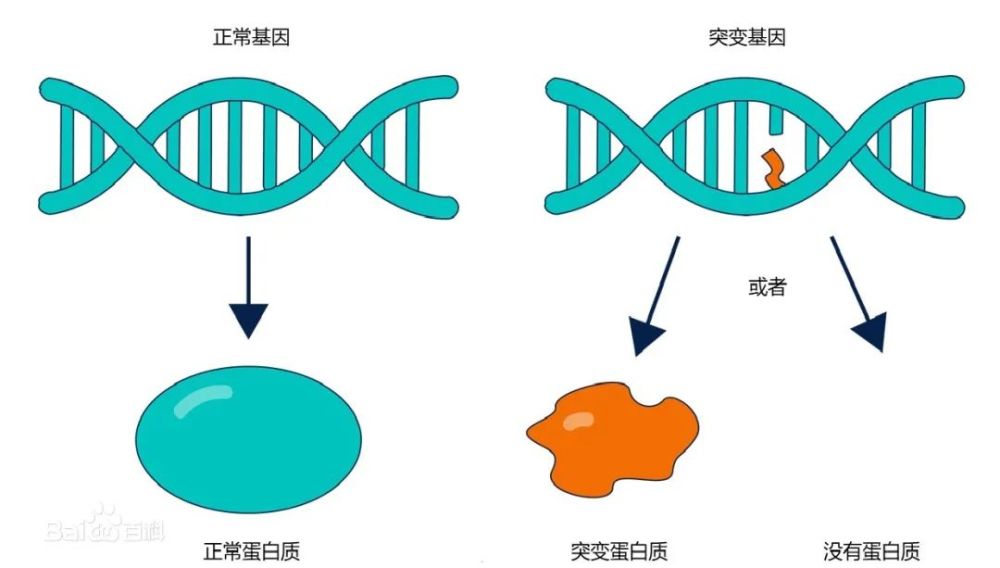
个人遗传因素在肿瘤的发生和发展过程中起着重要的作用,决定了个人的肿瘤易感性。
在常染色体显性遗传方式下,若父母有一方携带有致病的肿瘤易感基因改变,则他们下一代会有50%的概率从父母处获得这个缺陷基因(遗传易感基因)。由于遗传性原因导致的染色体和基因异常,可使某些肿瘤的机会大大增加,病理学上称之为遗传性肿瘤综合征,通常为常染色体显性遗传,肿瘤平均发病年龄较散发患者早,且为成对器官的双侧肿瘤,如双侧乳腺癌,还可表现为同一个人的多发性原发肿瘤。
遗传性乳腺癌-卵巢癌与BRCA1/2、RAD51C、RAD51D、BRIP1等基因有关,其中BRCA相关乳腺癌和/或卵巢癌占比最大,研究最多。一项对1887例BRCA1/2基因致病性突变携带者的前瞻性研究发现,BRCA1、BRCA2基因致病性突变携带者70岁前患乳腺癌的平均累积风险分别为60%、55%,患卵巢癌的平均累积风险分别为59%、16%。
回顾朱莉的案例,其母亲在49岁时患卵巢癌,外祖母、姨妈均为乳腺癌,基因检测显示BRCA1突变,符合遗传性乳腺癌-卵巢癌综合征(HBOCS)。
在所有卵巢癌患者中,HBOCS 占10%-15%,为了及早发现此类患者,有效降低患者及其家族的致癌风险,遗传咨询和遗传检测尤为重要。
遗传咨询向咨询对象及其家属普及肿瘤风险相关的知识,为其选择遗传学及其他检测提供准确的信息,并能帮助咨询对象正确理解和接受检测结果;而在遗传检测方面,HBOCS中80-90%存在BRCA1和BRCA2的胚系突变,因此BRCA1/2检测是HBOCS的重中之重,此外还可以根据患者的情况进行多基因Panel检测等。遗传咨询和遗传检测在卵巢癌中的作用已经在2020年NCCN指南中明确,完整的遗传咨询应当包括获益,风险与局限分析、收集全面的家族史、收集详细的内外科病史、以及重点部位查体等;
出现以下情况时需要进一步做遗传检测,包括:
≤45岁罹患乳腺癌患者;
≤50岁罹患乳腺癌且1位近亲罹患乳腺癌或家族史不明;
≤60岁的三阴性乳腺癌患者、上皮性卵巢癌患者、男性乳腺癌患者;
1代或2代亲属符合以上标准者(仅当患病家属无法进行检测时才对未发病者进行检测)。检测结果可用于评估咨询对象患肿瘤的风险、探讨后续检测和家族成员检测的必要性,并帮助患者接受及时而恰当的处理。
BRCA突变是开启卵巢癌PARP抑制剂一线维持治疗的金标准
针对遗传性卵巢癌患者的研究发现,携带BRCA1/2基因致病性突变的患者通常预后较好,一项纳入34项卵巢癌研究的荟萃分析结果也显示,BRCA1/2突变的卵巢癌患者对铂类化疗药物的敏感性更高,接受PARP抑制剂治疗的疗效也更好,因而具有更好的预后。
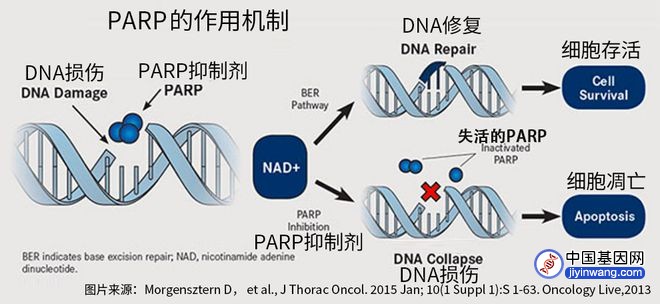
从机制上来看,PARP抑制剂的作用是阻断DNA单链的修复,而含有BRCA突变的肿瘤细胞由于缺乏BRCA编码蛋白而无法通过同源重组来修复DNA双链断裂,因此在携带BRCA突变的肿瘤中使用PARP抑制剂,DNA损伤不断积累,最终将导致肿瘤细胞死亡。因此BRCA基因检测除了用于遗传咨询外,在临床上常用于指导卵巢癌患者用药。
基于PARP抑制剂奥拉帕利SOLO-1研究的卓越成果,2018年FDA迅速批准其作为BRCA突变卵巢癌、输卵管癌及原发性腹膜癌患者一线化疗后达到PR或CR后的长期维持治疗。在2年后的欧洲肿瘤内科学会(ESMO)大会上, SOLO-1研究5年随访结果不负众望,让妇科肿瘤医生看到了晚期卵巢癌治愈的希望。
其结果显示:奥拉帕利使BRCA突变卵巢癌患者中位PFS前所未有地延长了42.2个月,相比于安慰剂组的13.8个月,维持治疗组中位PFS长达56个月,疾病进展或死亡风险降低67%(HR=0.33,图1)。奥拉帕利组48%的患者5年无疾病进展,而安慰剂组仅为21%,说明奥拉帕利一线维持治疗可使近一半的BRCA突变患者长期获益,实现了卵巢癌治疗史上首个“临床治愈”的目标。
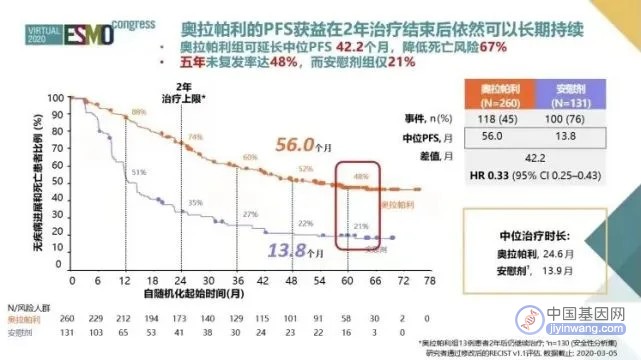
图1. SOLO-1研究5年PFS随访结果
需要注意的是,虽然SOLO1研究的随访时间是5年,但奥拉帕利组的中位治疗时间仅为24.6个月,这说明奥拉帕利的PFS获益在2年治疗结束后依然可以长期持续。
超过半数基线时化疗为CR随后接受奥拉帕利2年维持治疗的患者,5年后疾病依然未复发(图2)。
此外,奥拉帕利组的中位PFS2和中位TSST也未达到终点,而安慰剂组分别为42.1个月及40.7个月,再次证实奥拉帕利维持治疗的获益可以持续,且不受后续化疗影响。
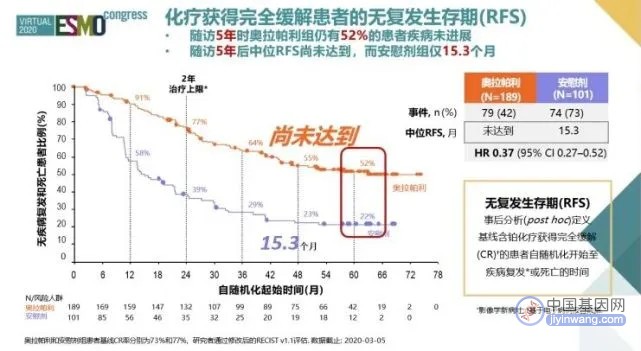
图2. SOLO-1研究5年RFS随访结果
BRCA1/2基因是评估卵巢癌发病风险、影响患者个体化治疗方案选择的最重要的生物标志物,NCCN、中国《卵巢癌PARP抑制剂临床应用指南》、《上皮性卵巢癌PARP抑制剂生物标志物检测中国专家共识》等国内外各大指南均推荐对新诊断卵巢癌患者进行BRCA1/2基因体系突变和胚系突变的检测,携带胚系/体系BRCA突变的患者推荐尽快开始PARP抑制剂一线维持治疗,以免错过实现“临床治愈”的最佳时机。
HRD检测扩大卵巢癌PARP抑制剂维持治疗获益人群
除了BRCA1/2基因外,还有许多基因与卵巢癌的发生、发展密切相关。
随着研究的进展,人们逐渐认识到同源重组修复通路(HR)相关基因突变的重要性。在高级别浆液性卵巢癌中,同源重组缺陷(HRD)发生率超过50%,理论上来讲,PARP抑制剂的“合成致死”作用机制应当不仅仅局限于BRCA突变,而应在HRD阳性患者中显示抗癌作用。近期的多项3期临床试验均证实了这一点,HRD阳性卵巢癌患者使用PARP抑制剂具有良好的临床获益。
综上所述,对卵巢癌患者进行基因检测并筛查出致病性突变,可以帮助医生对患者进行精准治疗,同时,对患者子女或其他一级亲属进行遗传咨询,可以使基因突变携带者得到及时干预,这将极大提高卵巢癌的早期诊断率,并降低疾病发病率。BRCA突变卵巢癌患者对PARP抑制剂反应更佳,对于携带胚系/体系BRCA突变的卵巢癌患者,尽早开始PARP抑制剂一线维持治疗可以使患者达到“临床治愈”。
参考文献:
[1[Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer.[J]. New England Journal of Medicine, 2018.
[2]2020 ESMO Abs 811MO
[3]2020《NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast and Ovarian》
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。