今年,关于“严禁外送”、“严查基因检测”政策的种种误读
今年以来,以“严查基因检测”、“严禁强推基因检测”、“严禁项目外送”为标题的内容不断见诸各大媒体,且都获得了广泛的传播。叠加上今年医疗反腐的空前浪潮,给从业者一种强烈的暗示:
“基因检测企业自带原罪”、“外送基因检测是腐败的温床”、“外送项目都会被逐渐取缔,必须院内检测”...
进一步深挖,其质疑的是“第三方医学检测实验室存续的合理性,以基因检测公司尤甚”。(关于第三方检测的价值,之前文章已写到:大白话 | 1+2+3+N,看懂第三方医学检验实验室ICL的行业价值)
发酵之下,不断有行业朋友表达了对临检行业前景的悲观情绪,也有一二级市场的朋友开始重新计算标的的估值、价格。

真相到底是什么?
媒体同道很少去关注内容本身,从中挖掘“基因检测”、“严禁外送”等关键字眼,便抛出来,甚至很多是断章取义;很多从业者朋友看了标题便草草结论。至于内容如何,谁发的文,关键点在哪里,并不清楚,也并不去细究。(这两年关于“LDT”的相关资讯也是同理,详见 LDT部门大裁员,表明国内LDT模式的全面失败?。)
这是一种恶性循环和负面情绪的累加,并无益于行业的良性发展,也无益于我们对行业前景、个人职业的准确预判。
本文做一下系统梳理,以帮助大家理清关键事项。其中观点,并不代表完全正确性,但提出了另外一种观察角度。强烈建议朋友们读一读政策原文,便心中有数。
01
样本外送≠医疗腐败
医疗行业是政策强相关行业,近年医改和监管政策频频,行业剧烈波动,更撩拨了从业者敏感的神经。但即使外界风声鹤唳,也并不意味着我们无法独立判断。
原文阅读是第一步。以笔者并不成熟的经验,关于政策文件,我们可以从以下方面初步判断:
(1)谁发的?国家、省市、组织?哪一个部门?
(2)性质判断:是法规、办法、规定、方案、通知、新闻报道?
(3)核心内容是什么?文件目的,面向对象,核心内容,及发文部门自己的解读。
(4)再依文件内容溯源,有无上位政策文件指引、周边政策文件的关联性、配套文件,看政策趋势,判断影响面和长期性。
今年,行业关注较多的医疗监管政策文件,可以大致分为两类:
1. 医疗反腐相关
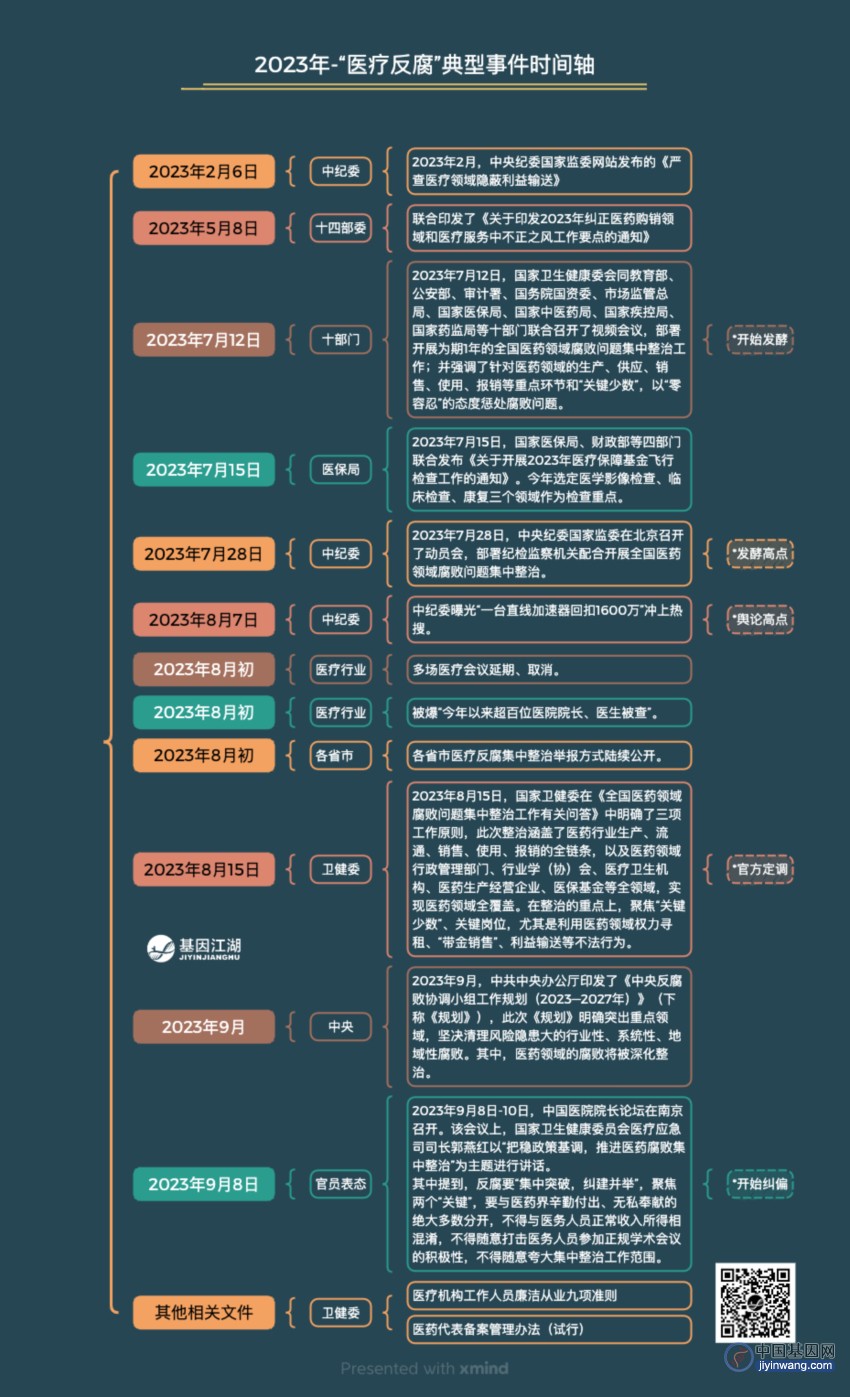
如“2023年5月,十四部门关于印发2023年纠正医药购销领域和医疗服务中不正之风工作要点的通知”;随后,卫健委、中纪委、医保局等国家部委、各省市、各医院,至上而下,开始制定本部门、本区域、本单位的方案;
“纠正不正之风”的通知,从2019年起,每年都会发文,已是一种常态化的监管方式。每年整治侧重点略有不同,但文件精神一致。今年,由于中纪委的参与和严格表态,掀起了医疗反腐的巨大浪潮,这种影响,从医疗领域扩大到全社会面,从而引起了广泛的舆论传播。
其中,耳熟能详的,“此次整治涵盖了医药行业生产、流通、销售、使用、报销的全链条;整治的重点上,聚焦‘关键少数’、‘关键岗位’,尤其是利用医药领域权力寻租、‘带金销售’、利益输送等不法行为”。
从内容来说,相较往年,并不鲜见,监管的核心内容都可以在“医疗机构工作人员廉洁从业九项准则”、“医药代表备案管理办法(试行)”等文件中找到出处。
医疗检测行业,此次文件相较往年,多了“治理...强推基因检测...等第三方服务”等字眼,这也成为各大媒体“严禁强推基因检测”的来源。
关于这个话题,之前所写“怎么才算“强推基因检测”?”已有阐述。
2. 样本外送相关
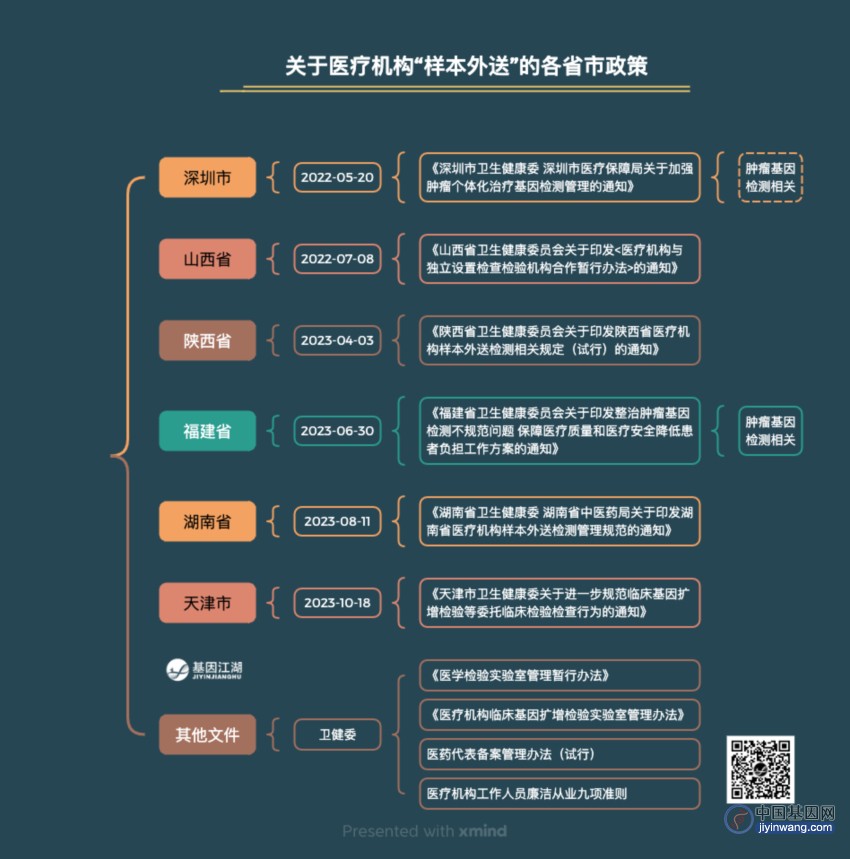
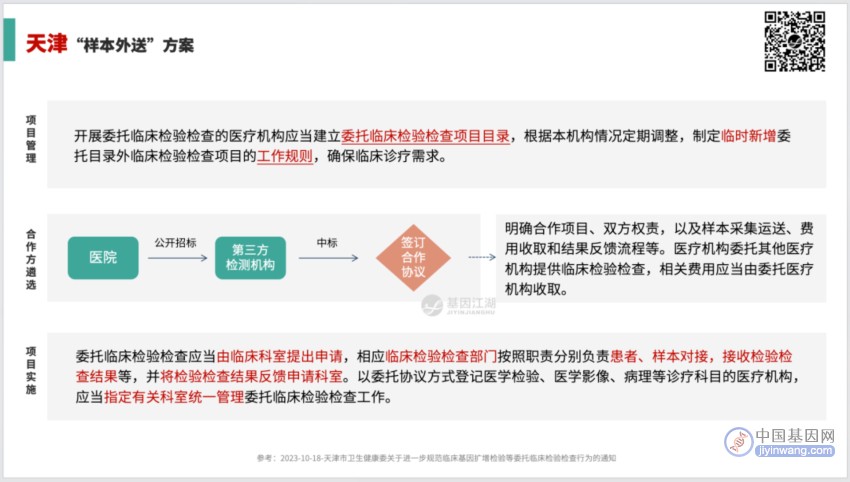
如:陕西省发布的“医疗机构样本外送检测相关规定(试行)”、湖南省发布的“关于印发湖南省医疗机构样本外送检测管理规范的通知”等、天津市“关于进一步规范临床基因扩增检验等委托临床检验检查行为的通知”;
或更具体的,针对某一类项目,尤其是肿瘤基因检测项目(和发生的医保套保事件有关):
如:福建省“关于印发整治肿瘤基因检测不规范问题,保障医疗质量和医疗安全降低患者负担工作方案的通知”、深圳市“关于加强肿瘤个体化治疗基因检测管理的通知”;
这是各省市关于医院样本外送的具体规定。
其中,各大媒体“严查检测项目外送”、“不允许外送”、“严查基因检测”等均来自于此,且每一省市发文,相关话题都会再次发酵、重复发酵,平添读者焦虑。
今年,由于“医疗反腐”与“样本外送”相关政策发文的时间点相互重叠,强化了二者的关联性,并在“基因检测”特别是“肿瘤基因检测”这一类项目上又刻意强化,容易引起内容混淆、关联、联想。
应该说,如“走廊收费”简单粗暴的样本外送模式容易滋生医疗腐败,但“样本外送”绝非只有走廊收费一种模式。
样本外送≠医疗腐败,这是我们要分辨的第一个事情。
02
“规范”≠“禁止”
“样本外送”会被禁止吗?哪些会被禁止?
遍览上文中4省2市关于“样本外送”、“委托检验”、“与独立第三方合作”的相关文件,尽管方案细节略有不同,但核心内容基本一致:
“规范”医院的外送行为,而非全部禁止。
“规范”的目的是“受控”。
对于“样本外送”管理的最关键环节:
将代表、医生、患者三方的私下个人行为,全部收归医院管辖。
检测公司只是受托检测的角色,“样本外送”只是单纯的检验外包行为;受检者不直接与检测公司发生任何联系。
以几个省市的方案为例进行说明:
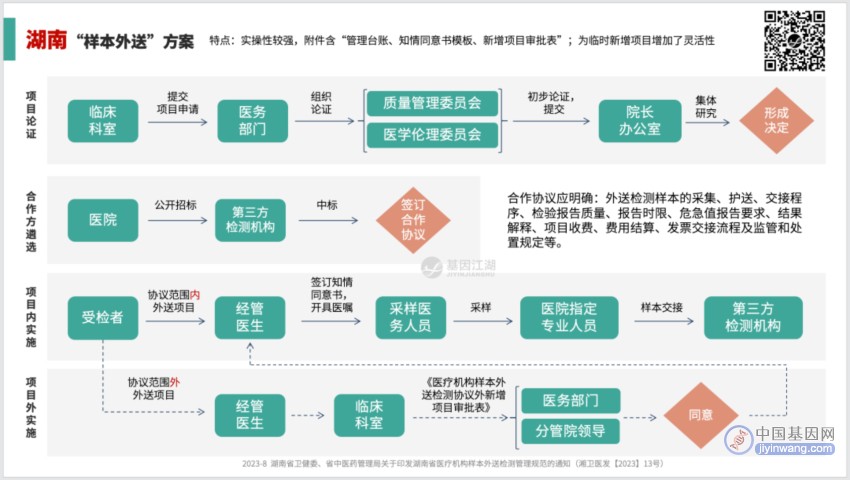
湖南方案:
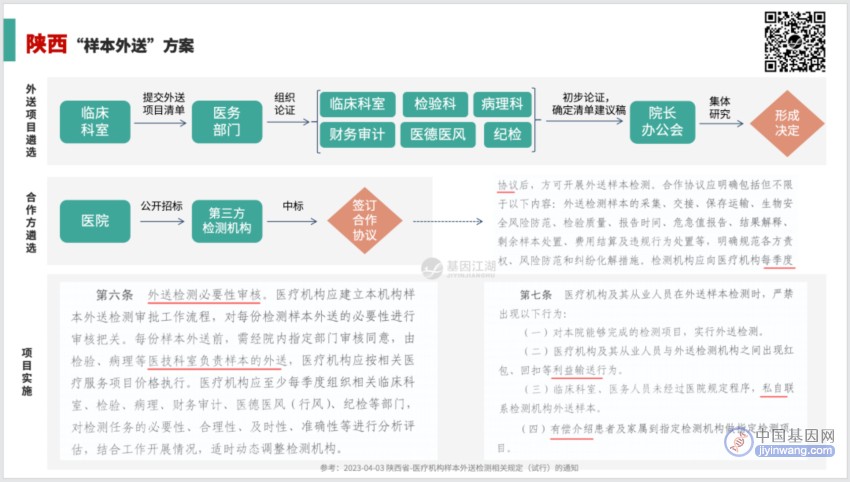
陕西方案:
天津方案:
所有的方案,为方便记忆,都可以简化为一个公式:2+3 。

2项 前置审核关键点:
(1)外送什么项目?
(2)和谁合作?
(1)外送什么项目?
即,审定外送项目的合理性、必要性,并制定外送项目的目录。
在这一个板块,部分政策文件中出现“严禁医疗机构将本院能够并适合开展的临床检验项目外送至第三方检测机构进行检测”,被很多媒体、同行朋友扩大释义。
其弹性空间在于,何谓“能够、并适合开展”?

“能够”,指代“具有能力”,医院有能力检测而选择外送,是什么原因?
答案是“不愿意做”,很多普检类项目即如此,医院自行检测成本反而高于检测外包,对于科室能力提升也无大的帮助,那就干脆外包出去;
“适合开展”的阐述空间会更大,受检者获益、检测成本、现有人员配置、检测TAT、科室能力建设,都可以是“本院不适合开展而转向外包”的原因。
所以,只要被认定为“项目对受检者有益”&“医院现阶段没有能力做”or“医院现阶段不适合做”,都可以选择“样本外送”。
项目的发起方,是临床科室;院方拥有最终解释权。
(2)选择哪家第三方合作?
确定了要引进的项目后,项目外包给谁?
明面上,第三方的资质、实力、商务条件都会成为重要考虑因素,然后以政府采购的形式进行合作方的遴选,签订合作协议,明确合作项目、双方责权。

在山西的文件中,除一般描述以外,明确提出了实验室应参加室间质评;获得相关质量体系认证为加分项。
这对第三方检测实验室应有提示,如何在正当的商业竞争中、规则允许的范围内取得更大的胜算?参加过招投标的企业应深有体会,工夫在平时。
3个 关键流向:
外送项目、合作方都确定了,实操中控制好3个关键流向:
资金流、样本流、报告流。

即,钱交到医院、样本由医院采集并寄送、报告由医院发放并解读。
只要把这三个流向监管起来,就不会出现大问题。
在基因江湖去年整理的“基因检测的12种营销模式”中,2.1→2.2的变化,即阐述了相关要点:
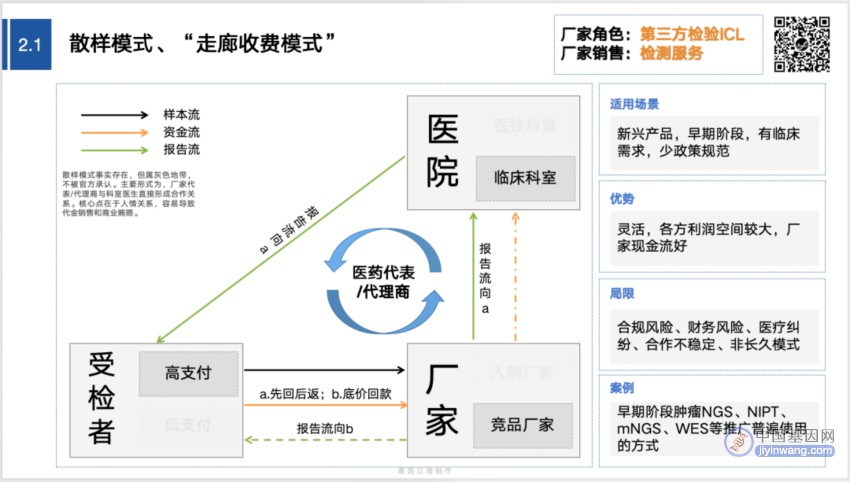
↓
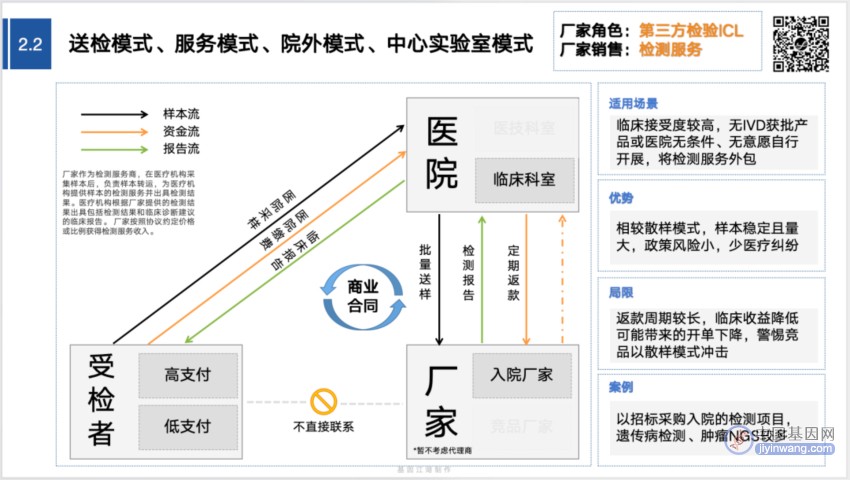
规范了“样本流”“资金流”“报告流”全过程以后,在实际运行过程中,所有人最重要的考虑点只有1个:“别出事”。
所有的政策文件都在强调一点:医院是第一责任主体。
“别出事”是底线,这意味着:
检测上,保证“检测的准确性和时效性”;
信息上,保证“患者隐私与信息安全”;
流程上,保证“按照既定的三个流向规范操作”。

记住2+3,所有关于“样本外送”的政策文件,都是对以上事件的明确,没有例外。
政策给定了“样本外送”的规范路径,并非一刀切的全部禁止,这是我们要分辨的第二个事情。
03
“规范”,有利行业长期发展
为什么要“规范”、要“监管”,一定是行业本身已经出现了诸多问题。
在十余年测序临检行业的发展过程中、在3年新冠检测期间,大量的问题暴露出来,基因检测行业甚至到了舆论口诛笔伐之地;行业自身发展也面临瓶颈。
笔者曾在“医械企业在“合规”与“活下去”中反复炙烤”写到:
“行业内约定俗成的潜规则有其历史渊源,或源于现实中的两难困境,但并非意味着其长期存续的合理性。
当潜规则甚至成为唯一单项选择,所有身处其中的人都主动投入或被动裹挟进入,而多种客观环境已经变化,但盘根错节的利益纠葛已经无法通过行业自律纠偏,就需要外力强力打破,重构价值(利益)链条。”
“监管”的力量,就是这种外力纠偏的力量。新的“规范”会打破原有的流通路径,建立新路径、新秩序。
对于很多企业而言,“规范”反而提供了进一步发展的重大机遇。
从短期看,尽管业务可能也会受到一定影响,但“规范”必然会淘汰落后、野蛮的合作方式,促进产业集中,对一部分企业、对行业发展长期有利。
我们应该如何做?
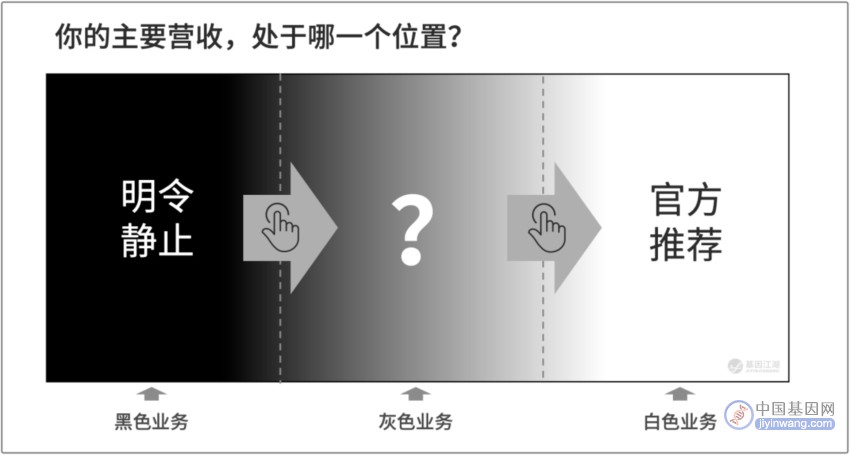
(*关于此图的解析,另开篇再写。)
无论对于企业,还是从业者,答案只有一个:
跟着政策指引,把主要业务做成阳光业务。
这种趋势也是必然的;不要迷恋过去的成功,不要和趋势对抗。
未来黑灰色的生存夹缝会越来越窄,这必定是更少数企业、更少数关键人的生存本事。
你会是这样少有的超级个体吗?又凭什么?
拥抱阳光。
篇尾:
未来,一定会有越来越多的地区,发布针对“样本外送”的监管政策;我们依然时不常可以看到“严禁外送”、“严查基因检测”的报道。
资讯爆炸的时代,读完此文,朋友们应有自己独立判断。媒体同道在出于行业警示、流量考虑的同时,也需重视传播对行业的影响。
再次建议朋友们读一读原文,如对外送政策感兴趣,其中“湖南”、“山西”文件可详读,实操性较强。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。