CAR-T之父最新论文:敲除两个基因,改善实体瘤的T细胞治疗效果
CAR-T细胞疗法是由每个患者自己的T细胞通过基因工程改造而来的,从患者血液中收集T细胞,在实验室中改造和扩增,然后作为一种“活细胞药物”重新输回患者体内。
宾夕法尼亚大学的Carl June教授的研究带来了2017年获批上市的世界首款CAR-T细胞疗法。目前,FDA共批准了6款CAR-T细胞疗法上市,彻底改变血液类癌症的治疗方式。然而,对于更常见的肺癌、乳腺癌等实体瘤,CAR-T仍然效果不佳。
2023年3月15日,宾夕法尼亚大学Carl June团队在《美国国家科学院院刊》 (PNAS) 上发表了题为: Combined disruption of T cell inflammatory regulators Regnase-1 and Roquin-1 enhances antitumor activity of engineered human T cells 的研究论文。
该研究开发了一种 帮助T细胞攻击实体瘤的“组合拳”新方法 ,通过CRISPR-Cas9敲除两种T细胞炎症调节因子Regnase-1和Roquin-1,可将T细胞扩增水平增加至少10倍,从而增强抗肿瘤免疫活性和持久性。这些结果表明,免疫炎症调节因子可能是提高CAR-T或TCR-T抗肿瘤反应的有潜力的靶点。

论文通讯作者Carl June教授表示,我们希望为实体瘤患者开发可用的CAR-T细胞疗法,包括最常见的癌症类型。这项新研究表明,靶向免疫炎症调节剂以增强T细胞的效力,值得进一步研究。

Carl June教授
CAR-T细胞疗法在实体瘤中的面临的主要挑战是T细胞耗竭(T cell exhaustion),即来自实体瘤的肿瘤细胞持续抗原暴露使T细胞损耗到不能产生抗肿瘤反应的程度。将来自实体瘤患者体内的已耗竭的T细胞用于CAR-T细胞治疗会带来较差的效果,这是因为这些T细胞无法有效扩增,也不能“记住”它们的任务(杀伤肿瘤细胞)。
之前的一些观察性研究提示,炎症调节因子Regnase-1是间接克服T细胞耗竭影响的潜在靶点,当T细胞被破坏时,Regnase-1会引起过度炎症,使它们恢复以产生抗肿瘤反应。研究团队猜测,如果同时抑制另一个相关但独立的炎症调节因子Roquin-1可能进一步促进抗肿瘤反应。
研究团队对两种处于临床阶段的T细胞疗法进行了研究,分别是靶向间皮素的CAR-T细胞疗法mesCAR-T和靶向人食管鳞状上皮癌抗原1的TCR-T疗法NYESO TCR-T。使用CRISPR-Cas9基因编辑技术分别敲除它们的Regnase-1或Roquin-1,或同时敲除Regnase-1和Roquin-1。
CRISPR-Cas9基因编辑后的工程T细胞被扩增并输入实体瘤小鼠模型中,研究团队观察到,敲除Regnase-1或Roquin-1均能提高CAR-T或TCR-T的效果。而双重敲除能够将工程T细胞扩增至少10倍,还增加了抗肿瘤免疫活性和工程T细胞寿命,带来最佳抗肿瘤效果,其中Regnase-1是主要贡献者。
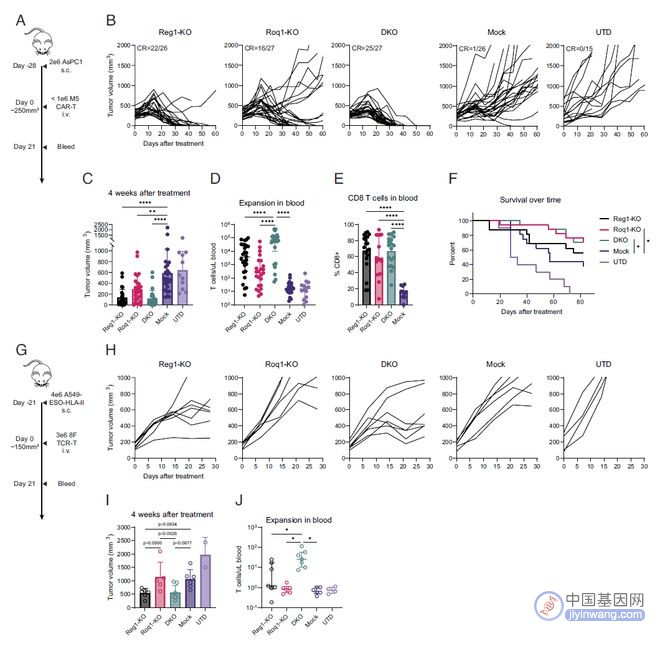
在实体瘤治疗中,经常看到CAR-T细胞的扩增受限,如果能够让这些T细胞更有效,并大量帮助大门大量扩张,就能让T细胞疗法更好地攻击实体瘤。
该论文的第一作者David Mai博士表示,这两个炎症调节因子中的每一个都涉及限制T细胞炎症反应,而将它们同时抑制比单独抑制一个产生更强大的抗癌效果,在之前研究的基础上,这项研究让我们越来越接近在实体瘤环境中有前景的CAR-T细胞治疗策略。
体内原位构建CAR-T细胞策略可以极大简化工艺流程、低成本、标准化制备、临床使用便利、降低不良反应,获得更稳定高效安全的治疗效果,从而将CAR-T细胞治疗向普通患者可接受的药品转变。
为此,bioSeedin柏思荟与生物世界发起一场由药企R&D和BD、投资人参与的在体CAR细胞疗法研讨会,由张江药谷战略支持。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。