什么是肿瘤基因检测?有哪些基因检测技术?需检测哪些项目?
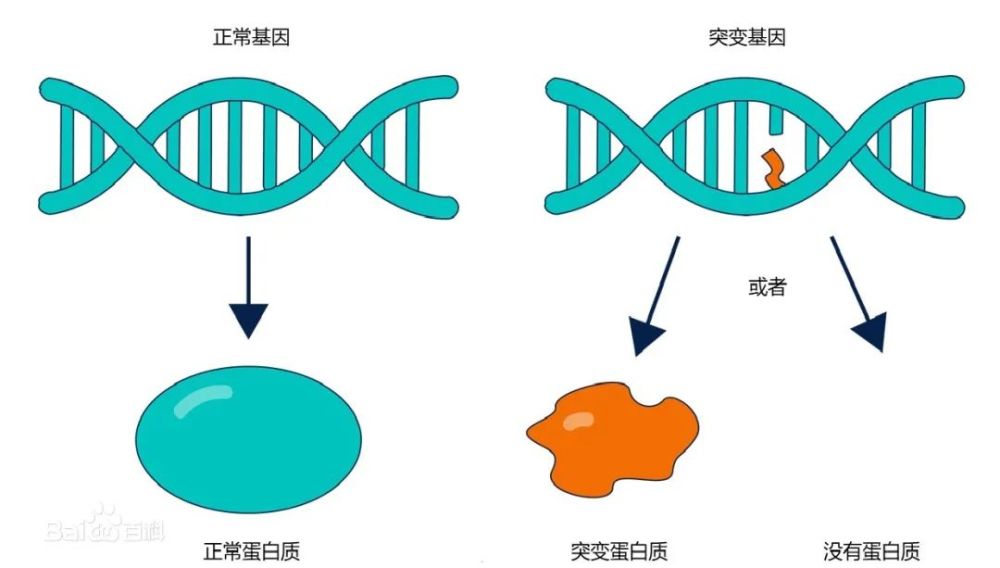
基因是携带有遗传信息的DNA或RNA序列 ,通过复制把遗传信息传递给下一代,指导蛋白质的合成来表达自己所携带的遗传信息,从而控制生物个体的性状表达。
肿瘤是多基因突变累积的结果,包括点突变、扩增、重排、缺失或表观遗传修饰的改变等。因此,从本质上说肿瘤就是一种基因病。
随着人类基因组计划的完成、后基因时代的到来,分子生物学技术的不断发展,对肿瘤相关基因检测逐步从基础研究走向临床应用。
从肿瘤预防的角度来说,基因检测能够筛选出高危患病人群;从肿瘤精准化治疗的方面来说,基因作为治疗决策依据的作用越来越强;对医生来说,会建议肿瘤患者做个基因检测匹配靶向药物;从检测结果来说,患者可能会看到某项基因检测结果是配上了或者配不上等等。
那么究竟什么是肿瘤基因检测,为什么要做肿瘤基因检测,目前有哪些肿瘤基因检测方法,常见肿瘤基因检测的临床应用价值如何,检测报告如何解读?
下面就此撰文跟广大读者聊聊肿瘤基因检测有关方面的知识。
什么是肿瘤基因检测?
利用现代分子生物学和分子遗传学技术,对血液、脑脊液、肿瘤组织等样本中相关的 DNA 或 RNA 进行检测,分析其所含有的基因类型、基因缺陷及其表达功能是否正常,实现对肿瘤高危人群的早期筛查、对肿瘤的诊断、对靶向药作用靶点的明确以及预后的评判等。例如:
①通过检测人乳头瘤病毒HPV各亚型,实现对宫颈癌的大规模早期筛查;
②患者外周血或骨髓标本通过检测发现存在 Ph 染色体和/或 BCR-ABL 融合基因阳性,是临床确诊慢性粒细胞白血病的必要条件;
③乳腺癌患者检测发现 HER2 阳性,临床上可对其进行靶向治疗;
④不伴 IgHV 基因突变的慢性淋巴细胞白血病患者进展快、容易对免疫化疗反应不佳,临床上能够预测该患者预后较差。
为什么要做肿瘤基因检测?
肿瘤基因检测因敏感性高、特异性强、适用范围广,有效弥补了传统诊断方法的不足,逐渐成为肿瘤诊疗的有效补充手段。
肿瘤基因检测不仅可以在合适的时间结合肿瘤患者的自身情况给予合适的治疗,还可以识别具有相同肿瘤发生部位、相同病理类型和病理分级的不同患者之间存在的差异。
包括基因表达产物、基因拷贝数变异和基因突变在内的检测,可确定是否有原发肿瘤或癌变的特定基因存在,从而在肿瘤诊断、提示肿瘤恶性程度、开展靶向药物治疗等方面提供帮助。
因此,肿瘤基因检测不仅有助于肿瘤的预防和早期诊断,更在恶性肿瘤的分子分型、疗效监测、预后判断、精准用药指导等方面起到重要作用。
目前,已有多种基因检测方案被纳入肿瘤精准化临床诊疗指南。
目前,肿瘤基因检测
有哪些技术手段?
肿瘤基因检测主要检测基因突变、基因表达、融合基因、基因甲基化等,检测技术手段多样,目前主要有以下几种:
①PCR-直接测序法,该技术可直接读取DNA的序列,能够发现新的突变位点,被认为是基因分型的金标准;
②PCR-焦磷酸测序法,该技术可对体细胞和甲基化等实现定量检测,分型准确可靠,通量较高,可发现基因新的突变或遗传变异;
③实时荧光定量PCR 技术,是当前基因检测应用最广范的技术,利用该技术检测 HPV-DNA对宫颈癌进行筛查,远远优于细胞学检测和醋酸碘实验,大大降低了宫颈癌的发生率和死亡率;
④荧光原位杂交(FISH)技术,是一门新兴的分子细胞遗传学技术,采用FISH 技术检测乳腺癌患者细胞内的 HER-2 基因是否发生基因扩增,不仅有助于乳腺癌分子靶标的诊断,还有助于乳腺癌患者的预后监测;
⑤基因芯片技术,是一种新型的基因功能分析技术,具有高通量、微型化和自动化的特点,利用该技术检测肿瘤P53基因的突变位点,对指导肿瘤治疗和预后都具有十分重要的意义;
⑥高通量测序技术,该技术是依靠高通量测序平台和生物信息学分析流程,在短时间内通过一次测试完成批量样本中全部基因数据的解读,既可以对已知的基因进行检查,也可以对未知的基因检查,从而完成对肿瘤易感基因进行疾病预测,对肿瘤进行诊断,对临床靶向用药进行指导,对患者预后进行判断等;
⑦数字PCR技术,是近年来迅速发展起来的一种高灵敏核酸定量分析技术,该技术结果定量不依赖于扩增曲线循环Ct值,且不受扩增效率的影响,特别在量化差异微小的样品区分中性能优异,利用该技术检测甲状腺乳头状癌患者BRAF V600E 基因是否突变,可预测复发风险及辅助鉴别甲状腺结节的良恶性。
但上述每种检测技术均有自己的优缺点,尚无充足的证据表明何种基因检测方法可以完全替代另一种方法,尚无单一的一种测试可以检测基因中所有突变,为确保检测到全部的突变,有时需要联合使用多种检测方法。
常见肿瘤基因检测项目
及其临床应用
理论上,基因检测越全面,检查的基因谱越多,给临床医生提供的诊断和治疗信息就越多。
但基因检测价格比较昂贵,且大部分需要患者自费负担,因此基因检测要从实用性、经济性等多方面全面考虑,慎重选择。
根据指南或指导原则,不同疾病、不同分期的患者有选择地进行基因检测,有助于临床的诊疗,也是最易被患者接受和使患者受益的。例如:
①对于非小细胞肺癌患者,进行EGFR 和 ALK基因融合突变检测,阳性则分别提示 EGFR 靶向药物(易瑞沙、特罗凯、阿伐替尼)、ALK 抑制剂(克唑替尼)对其有效,当发现 EGFR 外显子 19 缺失,提示对吉非替尼等敏感,发现T790M 突变提示对吉非替尼等耐药,同时 C797S 突变提示对 T790M 突变耐药;
②对于转移性结直肠癌患者,进行RAS(KRAS和 NRAS)基因突变检测,阳性患者均不应接受 EGFR 单克隆抗体类药物的靶向治疗,RAS 基因野生型是接受西妥昔单抗治疗的先决条件;
③对HER-2 过表达的晚期胃或胃食管结合部腺癌患者,指南推荐在化疗的基础上,联合使用分子靶向治疗药物曲妥珠单抗效果更好;
④对于乳腺癌患者,HER2 基因扩增或过表达可进行靶向治疗,国内主要药物有曲妥珠单抗、帕妥珠单抗、吡咯替尼、T-DM1、拉帕替尼等;
⑤对于BRCA1/2 胚系突变的女性携带者,指南推荐其在完成生育后接受输卵管-卵巢切除术降低风险;
⑥对于慢性粒细胞白血病患者,通过检测药物治疗前后 BCR-ABL 融合基因表达水平,能够评估其疗效,当含量持续下降说明治疗有效,含量上升则提示肿瘤复发。
因此,对不同的患者进行选择性肿瘤基因检测,筛选出真正获益人群,才是肿瘤基因检测的核心。
肿瘤基因检测报告如何解读?
通常一份基因检测报告的第一页会包括检测时间、检测标本类型、检测技术以及最主要的结果展示。
如果看到某一项后面写着突变或者(+)就表明这个基因存在突变。现在很多都是高通量测序,后面还有标有这个突变的丰度值,通常来说丰度值越高意味着这个基因突变越多。
对于有明确靶点的药物,须遵循靶点检测后方可使用的原则,检测结果的报告方式为:“未检出”/“未检测到突变” / “检测到突变”。
对于健康受试者的基因检测,主要针对与临床表型相关或高度怀疑的变异位点进行筛查,如果检测阳性则需要对受试者进行风险评估与预测,需要专业人士进行解读,必要时需要联合受试者、临床医师、检验医师、遗传分析师对报告进行综合分析。
注意!!
尽管基因检测为肿瘤的精准筛查、治疗和预后评估提供了新的依据和切入点,但是,临床形成的统一技术指南和标准规范较少,有的只形成部分专家共识。
其次,基因检测平台标准不一,试剂盒种类多,质量参差不齐,标准化和质量控制有的还未形成共识。
最后,基因检测属于预防医学范畴,检测结果显示患病风险,不等于已经患病,或者将来一定会患病。
另外,由于各种检测技术灵敏度差异,突变等位基因需要超过一定比例才能被检测出来,容易出现假阴性概率。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。











![2022年全球基因检测行业发展趋势分析[图] 2022年全球基因检测行业发展趋势分析[图]](/static/upload/image/20221216/1671182866176593.jpg)