tRNA疗法,正在成为基因治疗新风口

1965年,美国科学家罗伯特·霍利(Robert W. Holley)首次分离了转运RNA(tRNA),并阐明了其序列与大致的结构,并因此获得了1968年的诺贝尔生理学或医学奖。
根据中心法则,DNA转录为mRNA,mRNA翻译为蛋白质,这是遗传信息的流动方向,针对DNA的基因疗法、针对mRNA的疫苗、针对蛋白质的靶向降解,在近几年获得了大量关注,并取得了许多突破。
然而,在这一遗传信息流动中非常重要的转运RNA(tRNA)却似乎被忽视了,tRNA是mRNA翻译为蛋白质的关键执行者,tRNA通过自身的反密码子识别mRNA上的密码子,并将该密码子对应的氨基酸转运至核糖体合成中的多肽链上,从而实现mRNA向蛋白质的翻译过程。
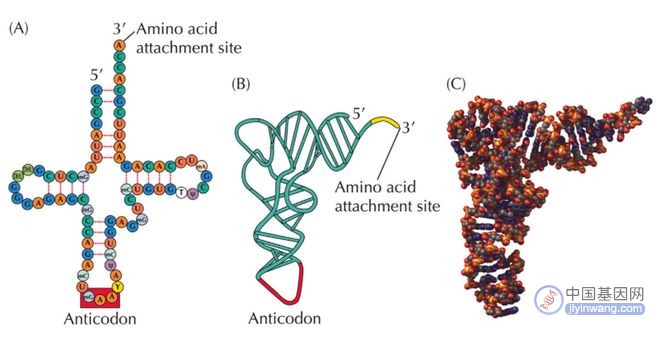
tRNA结构
tRNA被边缘化的情况在最近被迅速逆转,2021年以来,至少有4家治疗性tRNA公司完成大额融资。
2021年11月,著名生物科技风投公司Flagship Pioneering投资5000万美元成立了一家名为Alltrna的新公司,该公司自称是“世界第一家tRNA平台公司”。该公司旨在通过开发工程化tRNA疗法治疗数千种因基因突变导致终止密码子提前、蛋白质翻译中止的遗传疾病和癌症。
但实际上,Alltrna 并不是唯一一家开发 tRNA 疗法的公司,甚至也不是第一家。
在Alltrna之前,ReCode Therapeutics、Shape Therapeutics 和 Tevard Biosciences 都已经出现。而在它之后,hC Bioscience于2021年2月23日获得2400万美元融资,让tRNA疗法领域再添重磅玩家。
所有这些公司都专注于或部分专注于tRNA疗法,通过设计工程化tRNA,让其携带正确的氨基酸并引入到突变产生的终止密码子的位置,就能让蛋白质继续翻译下去,从而达到治疗疾病的目的。
据估计,大约11%的遗传疾病是由于基因突变导致终止密码子提前,蛋白质翻译提前终止所致(即所谓的无义突变)。因此,理论上仅需一个这种阻抑tRNA(suppressor tRNA)就可以消除这种无义突变导致的翻译提前中断,从而治愈数千种不同的遗传疾病。
如果这种tRNA疗法能够安全地进行,将为基因治疗打开一扇全新的大门。
tRNA疗法的发展历程
使用阻抑tRNA(suppressor tRNA)来治疗人类疾病的想法可以追溯到40年前,1982年,加州大学旧金山分校简悦威(Yuet Wai Kan)教授在Nature发表论文【1】,提出了通过阻抑tRNA来治疗β-地中海贫血的方法。


美国科学院院士、中国科学院外籍院士简悦威教授
2000年,科罗拉多大学博尔德分校Massimo Buvoli等人在转基因小鼠中验证了tRNA疗法的可行性【2】。2002年,俄罗斯圣彼得堡奥特妇产科研究所Anton Kiselev等人使用突变的阻抑tRNA来治疗无义突变的杜氏肌营养不良(DMD)小鼠【3】。
但当时其他治疗方法,如基因替代疗法和促通读药物展现了更好地治疗效果和前景,因此tRNA疗法领域的绝大多数人放弃了tRNA疗法。
在此后相当长的一段时间里,tRNA疗法的研究停滞不前,围绕阻抑tRNA治疗性用途的早期专利也从未获得许可或进一步开发。这在很大程度上是由于当时的技术还没准备好,那时候很难想象如何将其高效地送到体内并在细胞中表达最够的量。
2014年,葡萄牙波尔图大学的Carla Oliveira发表论文【4】,揭示了阻抑tRNA(suppressor tRNA)具有治疗或预防由无义突变引起的家族遗传性癌症的潜力,但这项研究同样没有引起其他科学家和投资人的注意。
但这种情况很快迎来了转机。
tRNA风口到来

成立于2015年的ReCode Therapeutics率先开始探索使用tRNA来治疗囊性纤维化。但该公司的研发重点是使用器官特异性LNP载体递送mRNA来治疗囊性纤维化、原发性纤毛运动障碍等疾病。

2018年,加州大学圣地亚哥分校的Prashant Mali创立了Shape Therapeutics,开始开发基于阻抑tRNA(suppressor tRNA)的疗法,用来治疗Rett综合征,这是一种由MECP2基因无义突变引起的神经发育障碍。
Prashant Mali 曾是乔治·丘奇(George Church)的博士后,也是最早研究CRISPR基因编辑研究人员之一。tRNA疗法只是 Shape Therapeutics 的研究方向之一,该公司还在研究基于腺苷脱氨酶(ADAR)的RNA编辑,以及新型AAV递送载体的开发。

Tevard Biosciences情况也类似,该公司的两位联合创始人Daniel Fischer和Warren Lammert他们二人的女儿都患上了一种名为Dravet综合征的罕见病,这是一种在婴儿期出现症状的发育性及癫痫性脑病,猝死率为10%,多数患者存在不同程度的认知发育落后,该疾病大多是因为SCN1A基因突变所致。
他们成立这家公司的目的是想逆转Dravet综合征,这也是公司名称Tevard的由来(Dravet倒过来拼写)。最初,该公司想通过碱基编辑技术进行治疗,碱基编辑技术开创者刘如谦(David Liu)也是该公司的科学顾问。
但在2017年,约翰·霍普金斯大学的Jeff Coller和Whitehead研究所的Harvey Lodish的一次交流改变了 Tevard Biosciences 公司的想法。Jeff Coller 当时已经证明了特定基因的mRNA中的密码子丰度与细胞中对应tRNA的浓度可以极大地改变蛋白质表达水平,也就是所谓的密码子优化的概念。他们意识到,可以利用这一点开发增强型tRNA疗法用来治疗Dravet综合征。
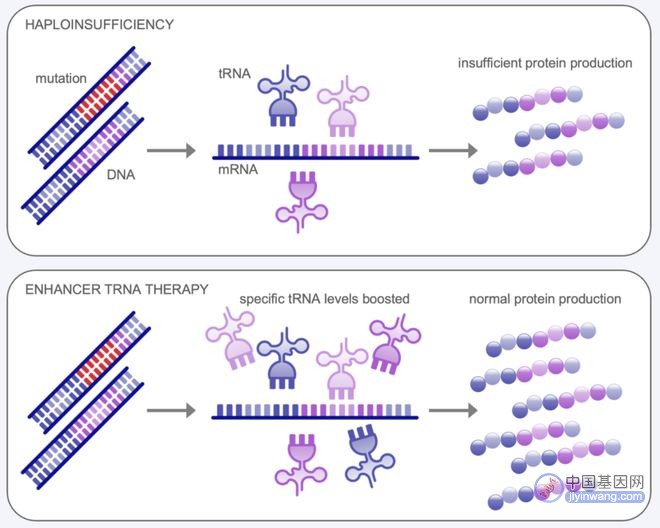
增强型tRNA疗法
目前,该公司已经证实,通过3种增强tRNA混合物,可以将SCN1A基因的表达水平提高约一倍,而不会显著影响其他基因的表达。此外,大约25%的Dravet综合征患者是因为SCN1A基因出现了无义突变所致,对这这些患者,还需要通过阻抑tRNA(suppressor tRNA)疗法来治疗。

2021年11月,Flagship Pioneering 投资5000万美元成立了一家名为Alltrna的新公司,该公司自称是“世界第一家tRNA平台公司”。该公司旨在通过开发工程化tRNA疗法治疗数千种因基因突变导致终止密码子提前、蛋白质翻译中止的遗传疾病和癌症。
Alltrna 公司表示,已经成功应用机器学习来揭示tRNA生物学的独特语言,这种语言比宇宙中的原子数量还多,可以将强大的生物学变成可编程药物。他们还表示,Alltrna 公司业界首创的平台整合了跨tRNA生物学和模态空间学习,以释放tRNA的全部治疗潜力并设计具有所需治疗特性的tRNA寡核苷酸。

2022年2月23日,hC Bioscience完成2400万美元A轮融资,tRNA疗法领域再添重磅玩家。
该公司除了开发针对无义突变导致的蛋白质翻译提前终止的疾病的tRNA疗法外,还开发针对由不需要的蛋白质引起的疾病的tRNA疗法,通过标记这种致病蛋白,从而破坏该蛋白,达到治疗疾病的目的。
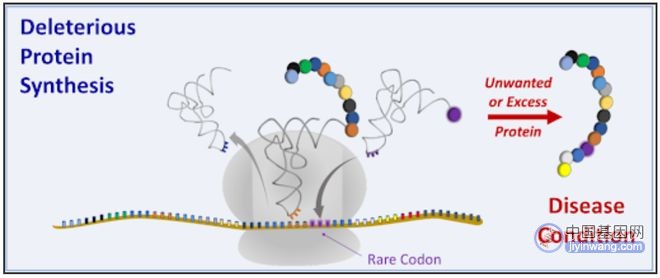
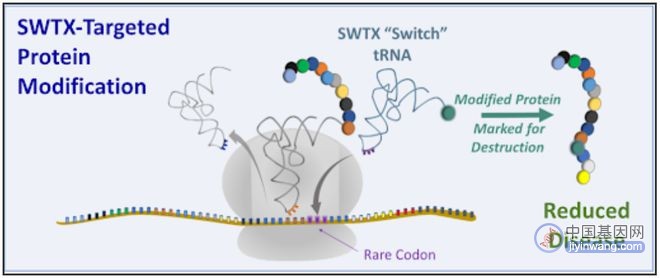
所有治疗性tRNA公司都希望利用其他类型基因药物取得的技术进步,包括mRNA疫苗、病毒载体递送的基因替代疗法,以及基于CRISPR的基因编辑疗法。但他们也面临着与这些基因疗法公司同样的难题——如何将治疗组分安全有效的递送到患者的细胞中。腺相关病毒(AAV)和脂质纳米颗粒(LNP)是目前大多数治疗性tRNA公司首选的递送系统。
北京大学药学院夏青教授团队于2021年8月在Nature Biomedical Engineering期刊发表论文【5】,该研究首次实现了利用基因密码子扩展技术恢复内源性Dystrophin蛋白的全长表达,在肌肉干细胞和PylRS/mdx小鼠疾病模型上系统评价了该方法用于治疗杜氏肌营养不良症(DMD)的安全性、有效性和可行性,并完成了不同方式递送AAV-PylRS-tRNAPyl系统的安全性和治疗效果评价,为DMD和无义突变罕见病治疗提供了新策略。

基于这项研究成果,夏青教授于2021年9月成了启夏解码(QiXia Decode Therapeutics),据悉,启夏解码已完成约1600万美元融资,目前正在推进肌营养不良疾病和结直肠无义突变肿瘤的研发工作。
夏青教授对《生物世界》表示,与其他类型的基因药物相比,tRNA疗法有两个明显优势,首先,对于这种终止密码子提前的无义突变,tRNA疗法具有通用性,一种tRNA疗法可治疗数千种遗传病;其次,tRNA很小,因此不会出现像使用AAV载体递送某些完整基因或CRISPR核酸酶时存在的尺寸限制。
2022年3月,美国麻省大学T.H.Chan医学院高光坪教授、王丹教授作为共同通讯作者在Nature发表了题为:AAV-delivered suppressor tRNA overcomes a nonsense mutation in mice 的研究论文【6】。
该论文报道了首次研发重组腺相关病毒(rAAV)体内递送无义突变抑制性tRNA治疗平台(AAV-NoSTOP)的研究,极大地扩展了基因治疗药物的应用策略。
研究团队首次成功利用重组腺相关病毒(rAAV)将阻抑tRNA(sup-tRNA)导入体内,诱导蛋白翻译在无义突变处的通读,在黏多糖贮积症I型(MPS-I)UAG无义突变小鼠模型上取得了长期稳定安全的疗效。

论文第一作者张跃表示,rAAV转导的sup-tRNA是一种全新的翻译通读治疗策略,适应症广泛,有文献报道,已在近1000个不同的人类基因中发现了7500多个无义突变;如果为每一种无义突变引起的疾病设计独特的基因治疗策略,这将是一项耗费惊人的项目。而我们开发的sup-tRNA通读治疗策略,同一种sup-tRNA有可能对许多种不同的,但由同一种提前终止密码子(PTC)引起的疾病起效;并且能够在无义突变处精确引入与正常基因编码的相同的氨基酸或是需要的氨基酸。与传统的基因替代疗法相比,rAAV转导的sup-tRNA策略无需提供可能超过rAAV包装限制的、可能引发免疫反应或具有细胞毒性的外源蛋白基因,是一种非常有价值的基因治疗新策略。
截至目前,还没有tRNA疗法进入临床试验,tRNA疗法的效果是否优于现有的基因替代疗法、促通读药物或基因编辑疗法,目前还不得而知。但可以肯定的是,tRNA疗法的通用性,一旦被证实能够安全有效地进行,将为基因治疗打开一扇全新的大门。
参考资料:
1.https://www.nature.com/articles/296537a0
2.https://journals.asm.org/doi/10.1128/MCB.20.9.3116-3124.2000
3.https://pubmed.ncbi.nlm.nih.gov/11862712/
4.https://www.nature.com/articles/ejhg2013292
5.https://www.nature.com/articles/s41551-021-00774-1
6.https://www.nature.com/articles/s41586-022-04533-3
7.各公司官网
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。