为下一代细胞疗法奠定基础,陈斯迪团队开发CLASH技术,实现大规模平行基因敲入

肿瘤免疫疗法蓬勃发展,为广大癌症患者带来了新的希望,其中,CAR-T细胞疗法无疑是最受关注的。简单来说,这种前沿癌症疗法就是收集癌症患者自身的T细胞,并对其进行基因工程改造和扩增,然后再回输到患者体内,这些改造后的CAR-T细胞就会精准摧毁癌细胞。
自2017年以来,FDA共批准了6款CAR-T疗法上市,这些CAR-T细胞疗法彻底改变了某些B细胞白血病、淋巴瘤和其他血液类癌症的治疗方法,让许多原本无望得到长期缓解的癌症患者得以康复。
然而,目前的CAR-T细胞疗法通常一次只能引入单个或少量的修饰,难以利用大量可能的基因组合和修饰来实现关键的细胞功能。因此,下一代细胞疗法的目标应该是同时设计大量的变异,并从中筛选出最理想的变异,从而生产出最适合患者的CAR-T细胞。
2023年1月26日,耶鲁大学医学院的陈斯迪团队在 Nature Biotechnology 期刊发表了题为:Massively parallel knock-in engineering of human T cells 的研究论文。
该研究开发了一个基于CRISPR的高效、高通量基因敲入平台——CLASH,通过腺相关病毒(AAV)文库编码大量同源重组修复模板,结合CRISPR-Cas12a的mRNA,实现大规模长链基因片段的精准敲入。
相比现有的以DNA为模板的大片段基因敲入,CLASH技术的毒性更低、通量更低、灵活性更高,可以应用于人类T细胞和其他类型细胞,加速细胞疗法的发现与筛选。

近年来,CRISPR技术的迅猛发展显著改变了基因编辑领域的格局,让科学家能够简单、高效地自由操纵基因。如今,在哺乳动物细胞中通过CRISPR基因编辑系统实现精确敲入的相关技术已相当成熟,但其细胞毒性影响了多重基因修饰的效率和产量,自然限制了在人原代T细胞中敲入基因的规模。
在这项研究中,研究团队致力于开发一种更高效、更灵活和细胞毒性低的基因编辑系统,以实现大规模的基因修饰和敲入。
研究团队使用了两种递送方式:
1、使用mRNA通过电穿孔递送基因编辑酶——Cas12a(也称为Cpf1);
2、使用腺相关病毒(AAV)递送Cas12a的CRISPR RNA(crRNA)阵列,以及嵌入HDR模板内的敲入转基因货物(比如CAR)。
其中,编码Cas12a的mRNA成分是恒定的,AAV载体可以很容易地设计和扩大容量,以携带大量的、多样化的货物,然后在硅树脂中合成并在体外包装。研究团队将这种组合平台命名为CLASH——CRISPR-based library-scale AAV perturbation with simultaneous HDR knock-in(CRISPR和AAV文库介导的密集平行同源重组基因敲入)。
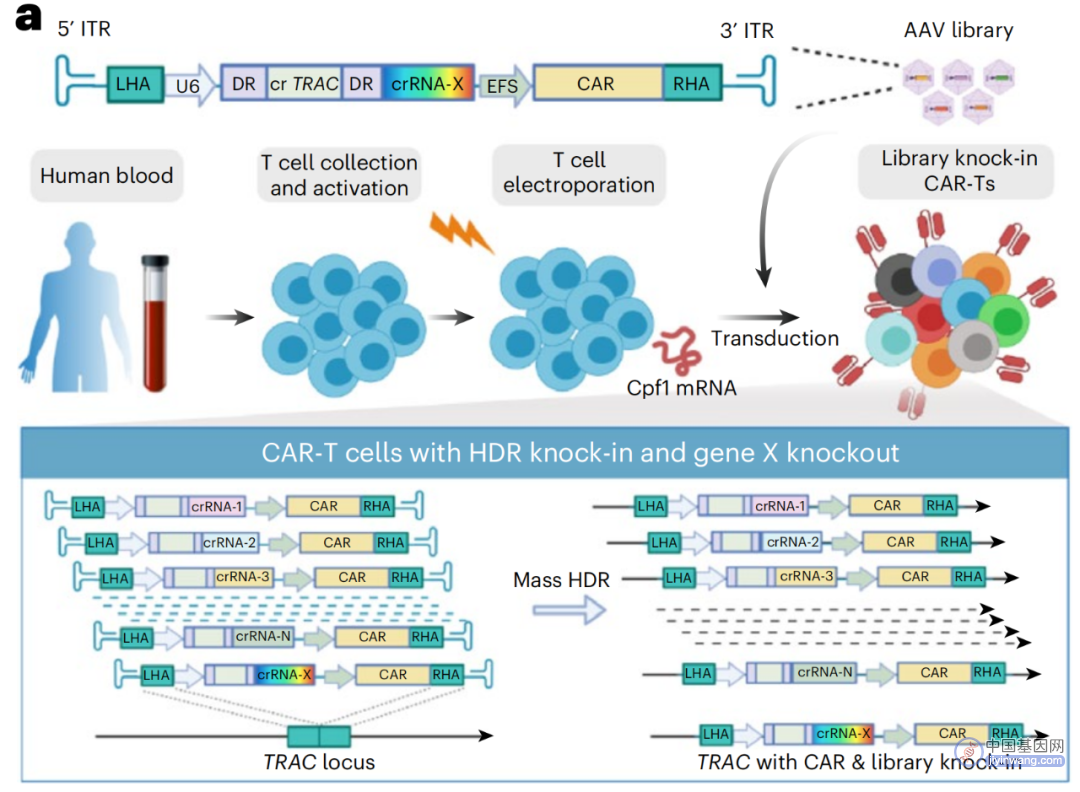
CLASH平台的具体流程
基于CLASH平台,研究团队设计了一个crRNA阵列文库,并将其称为笛卡尔文库。该文库通过HDR与CAR转基因同时敲入,携带crRNA阵列和CAR变体的AAV库嵌入HDR臂,与Cas12a mRNA结合,可以同时产生大量CAR- T细胞变体。
不仅如此,CLASH还可以针对特定的基因,并能够有效地并行生成大量基因敲入,方便研究人员可以选择有前途的细胞治疗候选药物进行验证和下游开发。
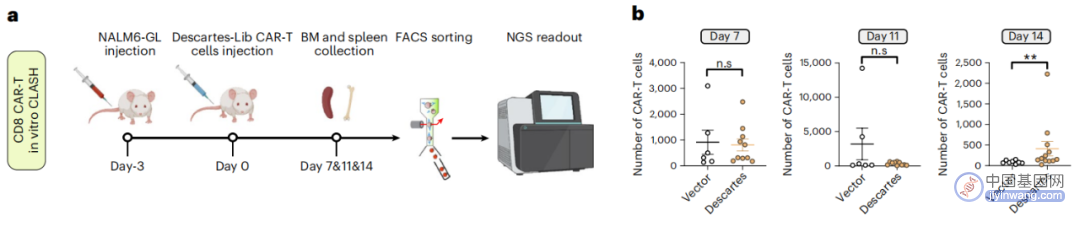
在白血病小鼠模型中,CLASH-笛卡尔文库实现大规模基因敲入
为了验证CLASH的应用潜力,研究团队将该技术应用于人原代T细胞,并在血癌和实体肿瘤模型中使用CD3、CD8和CD4 T细胞进行了时间过程的碰撞实验,实现了CAR-T细胞的混合生成以及有利的CAR-T变体的无偏倚筛选。
研究团队获得了一种独特的crRNA在CAR-T中产生PRDM1的3号外显子跳跃突变体,该突变导致这些CAR-T细胞的增殖、干细胞样属性、中央长效记忆和寿命增加,从而在多种癌症模型(包括实体瘤模型)中具有更高的体内疗效。此外,CLASH的多功能性也使其可以广泛适用于各种细胞和治疗工程应用。
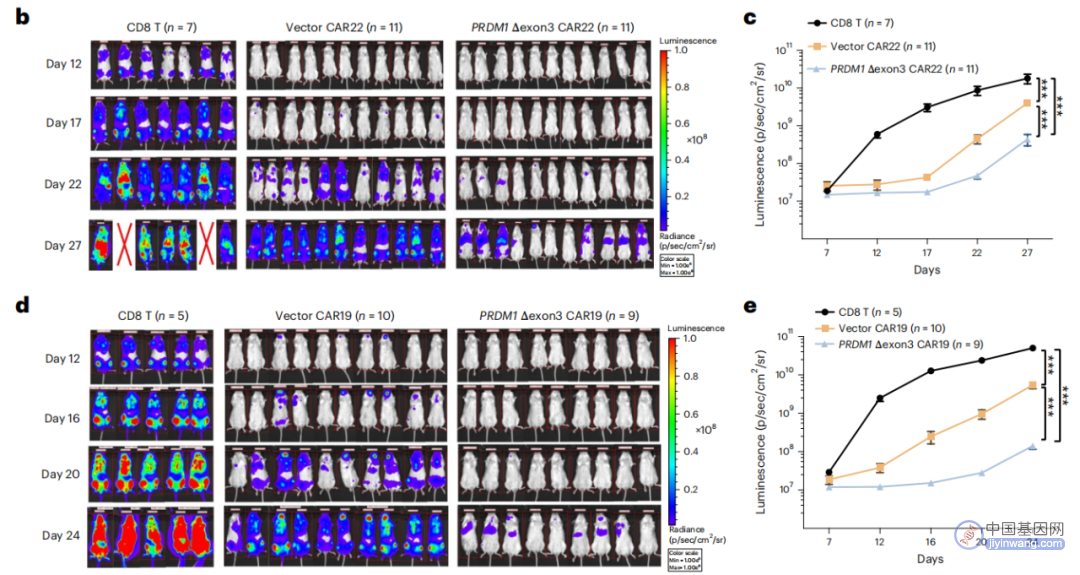
PRDM1-Δexon3-CAR-T细胞在多种小鼠癌症模型中显示出增强的体内治疗效果
对于这项工作,瑞士洛桑联邦理工学院唐力教授评论道:增强T细胞功能的CRISPR筛选平台大多基于随机集成系统,存在插入突变的潜在风险。但陈斯迪实验室的这项研究报告的这种名为CLASH的技术,可将数十种结构物靶向敲入T细胞受体位点,从而实现高效率和低细胞毒性的高通量CRISPR筛选。总的来说,与现有的CRISPR筛选T细胞治疗技术相比,CLASH有了重大进步。
论文链接:
https://www.nature.com/articles/s41587-022-01639-x
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。