中国科学院动物所等揭示基因组古病毒复活驱动大脑衰老
额叶是与认知和行为控制有关的脑的重要组成部分。随着年龄增长,额叶功能逐渐退化。它的神经解剖学和神经生理学变化是额颞叶痴呆和阿尔茨海默病等神经退行性疾病的基础。然而,认知老化先于神经退行性疾病表征数年出现,这对于人类认知减损的早期诊断和治疗提出了挑战。此外,由于额叶衰老及其神经元变性涉及复杂的细胞结构和功能变化,加之细胞在表观遗传和基因表达等分子调控水平的复杂性,使得目前对驱动灵长类额叶衰老的细胞和分子机制的认知有限,制约了针对脑衰老及神经退行性疾病的临床评估与干预策略开发。
6月1日,中国科学院动物研究所刘光慧研究组、曲静研究组,联合北京基因组研究所张维绮课题组、首都医科大学宣武医院王思课题组,在《细胞报告》(Cell Reports)上,在线发表了题为Nuclear lamina erosion-induced resurrection of endogenous retroviruses underlies neuronal aging的研究论文。该研究首次系统地解析了灵长类额叶衰老伴随的组织转录组、单核转录组、蛋白质组及全基因组DNA甲基化层次的多维改变,进而,利用神经病理学检测体系和体外人类神经元衰老模型,提出核纤层(Nuclear lamina)磨损引起异染色质(Heterochromatin)松弛以及基因组内源性逆转录病毒(Endogenous Retrovirus,ERV)复活,激活细胞天然免疫通路并诱导神经元衰老和炎症的理论,并据此发展可延缓神经元衰老的新型干预策略,为发掘额叶衰老及相关退行性疾病的早期预警标志物和潜在干预靶标提供了重要依据。
科研人员解析了食蟹猴额叶的衰老过程,发现了衰老神经元中核纤层磨损(如B型Lamin蛋白的减少)和异染色质的缺失可导致基因组中ERV转录激活且表达出病毒蛋白并进而形成病毒颗粒。在衰老神经元的胞浆中,ERV的反转录产物通过激活cGAS-STING天然免疫通路进而诱发神经元的衰老和炎症反应。研究人员建立了人类胚胎干细胞衍生的神经元体外衰老模型,并基于此验证了核纤层蛋白Lamin B1和Lamin B2的缺失及其诱导的ERV复活是神经元衰老级联反应中的起始事件。进一步,研究通过发展基于靶向ERV或cGAS通路的siRNA基因沉默体系,实现了对人神经元衰老的抑制。研究发现,抗艾滋病药物阿巴卡韦可以通过抑制ERV逆转录酶,有效抑制人类神经元的衰老。此外,口服阿巴卡韦的老年小鼠也表现出额叶神经元衰老的延缓及认知能力的改善。
该研究首次揭示了核纤层磨损引起的内源性逆转录病毒复活可以作为人类额叶衰老的驱动力及生物标志物,为脑衰老的科学评估和预警、脑衰老及相关神经退行性疾病的防治提供了新的线索和思路。在技术方面,研究综合运用多层次组学、人类胚胎干细胞衍生的神经元模型、基因沉默和免疫学成像等技术,捕获了ERV古病毒的复活、反转录和激活天然免疫通路等生物学过程,开创了人类脑衰老研究的新视角;在转化医学方面,研究以ERV古病毒复活周期的不同环节为靶标开发出多样化的神经衰老干预技术,为脑衰老相关疾病的防治提供了全新策略。
该研究揭示了介导灵长类额叶衰老及认知功能减退的新型分子通路,为人类脑衰老及神经退行性疾病的科学评估和预警提供了新型的生物标志物,并为发展干预脑衰老及神经退行性疾病的靶向药物奠定了理论基础。未来,围绕脑衰老伴随的ERV古病毒复活,将涌现出更多的科学问题。例如,ERV激活是否可以发生在其他脑区的特化神经元中?ERV能否通过级联感染年轻神经元或其他神经胶质细胞,介导神经衰老的细胞间传递?ERV能否在不同的基因组位点之间“跳跃”,介导神经细胞的基因组失稳?逆转录酶抑制剂能否延长哺乳动物寿命,能否促进老年个体的健康水平?随着科学研究的不断深入,期待这些谜题将逐一得以揭示。
北京大学第三医院、天津医科大学总医院、首都医科大学附属北京天坛医院的科研人员参与研究。
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00604-6

图1. ERV病毒颗粒(Retrovirus-like particle,RVLP)在衰老的人类神经元中聚集
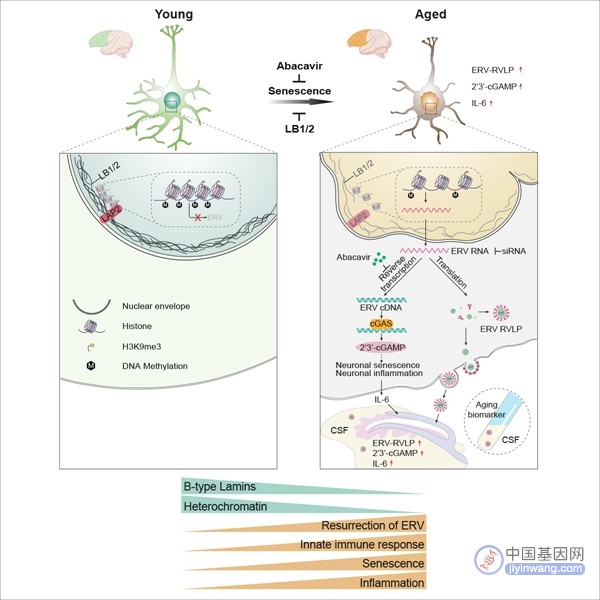
图2. 核纤层磨损诱导的内源性逆转录病毒复活驱动神经元衰老的机制与干预策略
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。