Cell重磅!基因突变逃过一劫,解密阿尔兹海默家族的「天选幸运儿」

阿尔茨海默病(AD)是一种常见的神经退行性疾病,会导致记忆、认知和行为能力逐渐下降。目前普遍认为遗传因素对疾病发生具有重要影响,然而其具体病因尚未完全明确。
2019 年,Nature Medicine 发表一项案例研究[1],哥伦比亚的一个大家庭有一半成员携带基因 PSEN1-E280A 致病突变,患有早发性 AD(平均年龄 44 岁);然而有「天选幸运儿」是个例外,家庭内携带该基因突变的一位女性比家族内其他基因突变携带者晚发病 30 年。遗传分析显示,该女性同时携带两个罕见的 APOE3 Christchurch(R136S),即 APOE3ch 突变拷贝。对其死后大脑的病理分析显示,有毒的 β-淀粉样蛋白团块含量很高,而 tau 蛋白负担却很少。
科学家对此疑问:APOE3ch 可能通过调节 β-淀粉样蛋白或 tau 蛋白的活性,进而预防阿尔兹海默症?
重磅最新!Cell 发表来自圣路易斯华盛顿大学医学院的 Chen 等人的最新研究成果,揭示了 APOE3ch 的保护机制。研究认为 APOE3ch 能够减少 β-淀粉样蛋白沉积,增强小胶质细胞对 tau 蛋白的摄取和降解,从而阻止 Aβ 诱导的 tau 蛋白播散。本研究阐明的细胞和分子机制可能有助于确定 AD 的新治疗靶点和策略[2]。

图片来源:文章截图
使用小鼠模型来研究早发性 AD
在 AD 患者中,β 淀粉样斑块的积累是 AD 发展的第一推动因素,这种积累可能始于认知能力下降症状出现的前几十年。此外,疾病进展会触发正常表达的神经元蛋白(tau)转变为不受调节的毒性状态,这两种蛋白协同作用,激活破坏性的生化进程。这个复杂的过程最终导致不可逆的神经细胞损伤。
为了研究 APOE3ch 突变对 AD 的保护作用,圣路易斯华盛顿大学医学院的研究人员采用了携带突变型 PSEN1 和淀粉样蛋白的 AD 小鼠模型。该模型的目标是重现 AD 患者大脑中观察到的 β 淀粉样蛋白沉积物的逐渐积累。然后注射从 AD 患者脑提取物中分离出的不溶性 tau 原纤维,用于模拟晚期 AD,其中 tau 蛋白可进一步诱导蛋白质错误折叠和聚集。
鉴于 APOE3 基因参与脂质转运,研究人员最初试图评估 APOE3ch 突变是否影响这一过程。与那位哥伦比亚妇女的病例类似,这些小鼠的周围神经系统(PNS)中的脂质水平异常高,但中枢神经系统(CNS)中的脂质水平却没有升高。此外,由于 APOE3 先前已被认为与神经炎症有关,因此该变量也是初步研究的主题。就这一点而言,APOE3ch 突变被证明对神经退行性疾病的进展具有保护作用——减少斑块中 β 淀粉样蛋白的积聚,以及淀粉样蛋白斑块周围 tau 蛋白的扩散和聚集。
小胶质细胞增强对 tau 蛋白的吞噬作用
已知 β 淀粉样斑块会吸引小胶质细胞,而小胶质细胞被认为在 AD 的淀粉样斑块的清除中发挥作用。出现痴呆症状的患者通常会表现出小胶质细胞激活异常。研究人员分析受 APOE3ch 突变影响的淀粉样斑块的活性,发现了小胶质细胞的募集增强。为了阐明该突变在小胶质细胞对 tau 细胞处理中的影响,该项研究人员使用了 StressMarq 的重组人 Tau-441(2N4R)P301S 突变型前体原纤维(目录号 SPR-329)。
StressMarq 的重组 tau 前体原纤维经过荧光标记以监测吞噬过程。与 pH 敏感荧光染料的结合表明 tau 在吞噬过程中被内化到小胶质细胞的酸性溶酶体区室中。有趣的是,由于与硫酸乙酰肝素蛋白聚糖细胞表面受体的结合不稳定,APOE3ch 突变导致人 tau 原纤维的降解和吞噬作用增加。Christchurch 突变进一步增强了其保护作用,能够抑制小胶质细胞释放 tau 蛋白聚集和扩散的能力,从而减少 tau 蛋白的进一步错误折叠和聚集。
StressMarq 产品助力研究 AD 的细胞机制
尽管罕见,但家族性 AD 可能会在生命的早期影响个体。受影响的患者通常在 40 多岁时开始表现出认知能力下降的症状,尽管个体可能早在 20 多岁时就被诊断出来。AD 引起的并发症显著增加过早死亡的风险。影响从 AD 斑块中 β 淀粉样蛋白最初积累到与 tau 过度磷酸化协同作用以及随后认知功能下降的因素仍然不明确。APOE3ch 突变通过改变影响 tau 聚集体吞噬作用的分子相互作用来阻止 AD 的进展。StressMarq 的 tau 原纤维有助于破译带有 APOE3ch 突变的小胶质细胞如何促进 tau 聚集体的降解。模仿 APOE3ch 突变的作用现在可能有助于开发预防 AD 进展的疗法。
通过改变影响 tau 聚集体吞噬作用的分子相互作用,APOE3ch 突变似乎可以防止 AD 的进展。StressMarq 的 tau 蛋白前体原纤维有助于破译携带 APOE3ch 突变的小胶质细胞如何促进 tau 蛋白聚集体的降解。模仿 APOE3ch 的作用可能是寻求阿尔茨海默病治疗方法的一个有价值的工具。
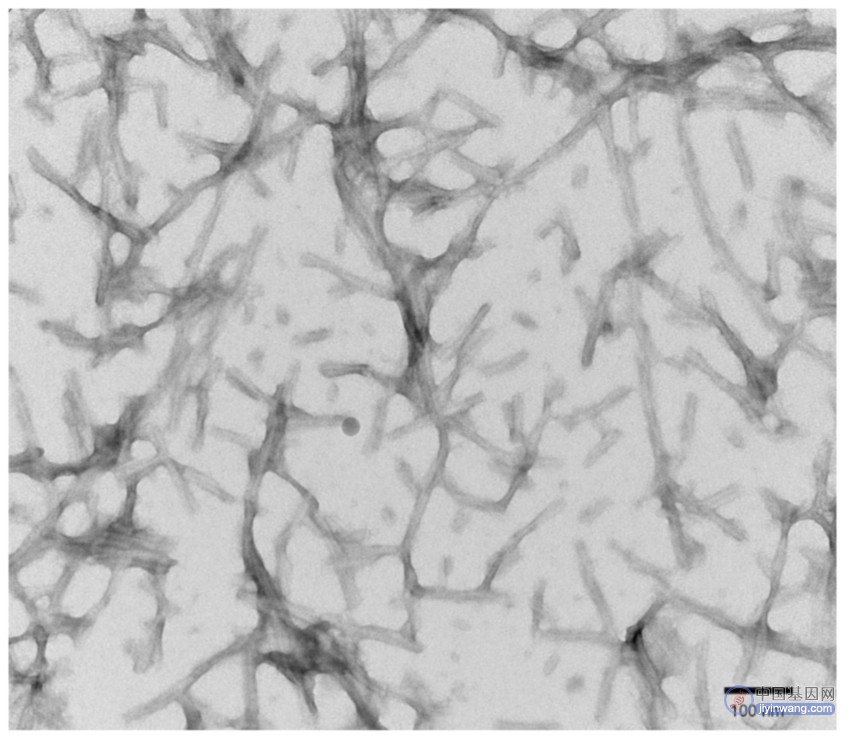
图 1. 活性重组 Tau441(2N4R),P301S 突变前体原纤维(PFFs)的透射电镜图(TEM),放大倍数为 150 kx。HV = 80 kV。前体原纤维经过声处理及乙酸双氧铀处理。(目录号 SPR-329)
相关 StressMarq 产品
StressMarq 生产一系列用于神经退行性疾病研究的蛋白质,例如淀粉样蛋白寡聚体和 tau 前体原纤维和单体 - 适用于分子、细胞和动物研究模型。重组人 Tau dGAE(297-391)模拟 AD 前体原纤维(无肝素辅助聚集)(目录号 SPR-502)高度复制了阿尔茨海默病患者中发现的疾病特异性 tau 折叠,以在研究模型中模拟 AD 病理学。
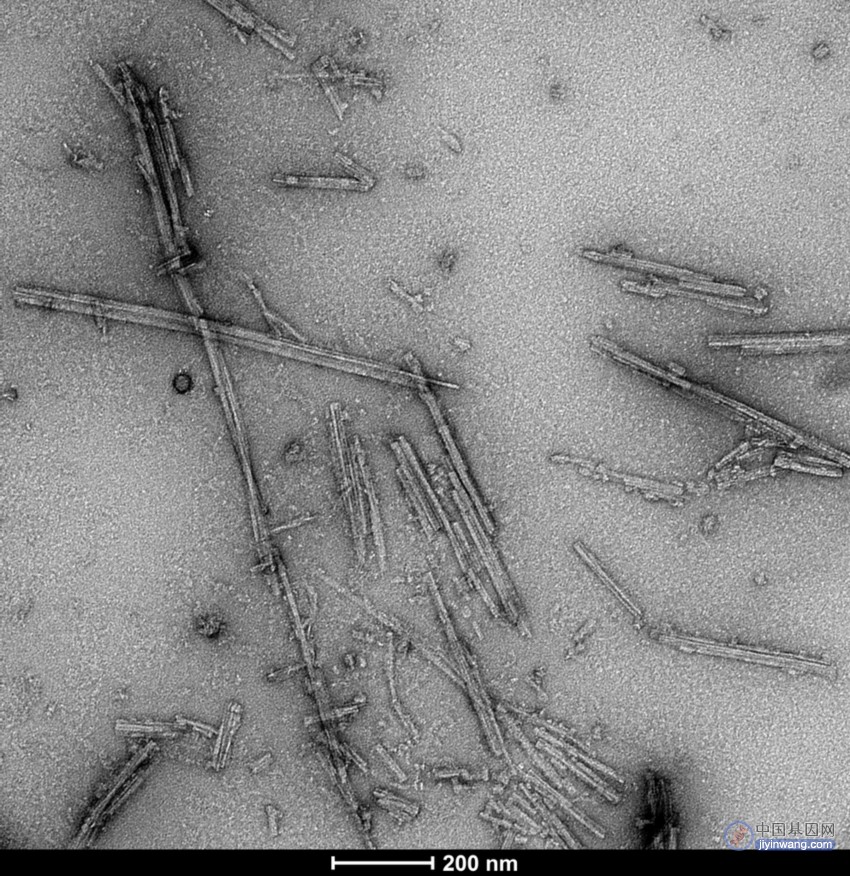
图 2. Tau dGAE 模拟 AD 原纤维(SPR-502)的 TEM,由 Tau dGAE 单体(SPR-501)在添加了 200 mM MgCl2 的 10 mM PB 和 10 mM DTT pH 7.4 中以 200 rpm 在 37 ℃ 下摇动 48 小时生成(Lovestam et al. 2022, eLife)。使用磷钨酸和乙酸铀酰染色剂在碳涂层 400 目铜网上在 80 Kv 下获得负染色透射电子显微镜图像。比例尺 = 200 nm。
除了 Tau 蛋白,StressMarq 还有一些列 α 突触核蛋白及 β 淀粉样肽产品。最新上线的一款 α 突触核蛋白抗体(SMC-617),可以特异识别聚集体。图 3 清楚地显示 2F11 抗体结合了 BF555 标记的原纤维,使其体量增大儿无法进入细胞,而没有添加 2F11 抗体的对照组中,BF555 标记的原纤维依然可以进入细胞。
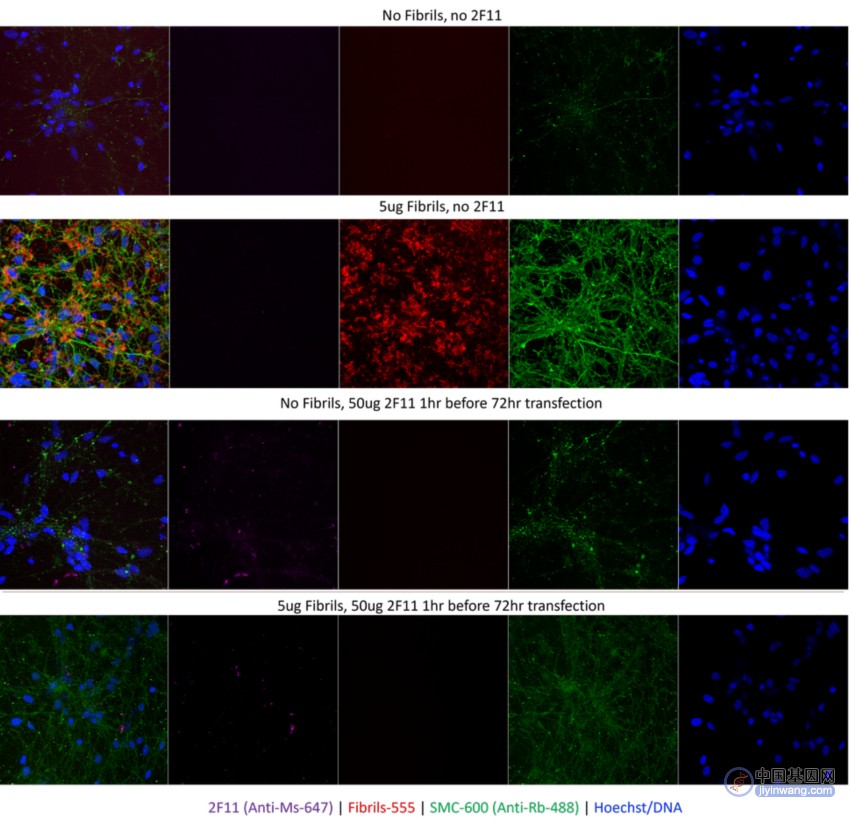
图 3. 添加或不添加 Alexa Fluor 555 标记的 α 突触核蛋白原纤维(SPR-322)的分化 8 天的 iPSC,在有 2F11 抗体和没有 2F11 抗体条件下的染色情况。SPR-322 Alexa Fluor 555 以 5 μg/孔添加,持续 48 小时,2F11(如果适用,在原纤维前 1 小时添加 50 ug/孔)。添加后 48 小时随后洗涤细胞,并在 24 小时后成像。成像和通道:2F11 抗体:647 nm(使用抗小鼠 647 标记物);原纤维:555 nm,磷酸化-ser129 抗体(SMC-600)488 nm,以及用于 DNA 的 Hoechst 染色。上方两图分别为:无原纤维,未添加 2F11;添加原纤维,无 2F11 抗体。细胞中的原纤维清晰可见,磷酸化 Ser129 信号也增强。下方两图分别为:无原纤维,添加了 2F11 抗体;添加了原纤维和 2F11 抗体。
参考文献
[1]. Resistance to autosomal dominant Alzheimer’s disease in an APOE3 Christchurch homozygote: a case report. Arboleda-Velasquez, J. F, et al., Nature Medicine. 2019.
[2]. APOE3ch alters microglial response and suppresses Aβ-induced tau seeding and spread. Chen, Y. et al. Cell. 2023.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。