手术无需麻醉,一生不会焦虑,罕见基因突变启迪新医学
65岁的时候,她才意识到自己是一名“超能力者”。
居住在苏格兰的乔·卡梅隆(Jo Cameron)是一位退休的苏格兰教师,一位具有社会责任感的素食主义者,当地社区的支柱——看上去,她只是一名普普通通,天性乐观的老妇人。
所谓“超能力”,并不意味着她能读取他人的意识,也不意味着她能操控天气或是单凭意念弯曲银汤匙。要说特别之处,那就是她不会感到疼痛、似乎从未体验过焦虑和恐惧,伤口的愈合速度也比大多数人更快一些。
一种新的基因突变
就像所有失去痛觉的人一样,乔小时候也有被烫伤但自己却浑然不觉的经历。不过和已知的先天性痛觉不敏症 (CIP) 患者有所不同,乔携带的基因突变,按BBC的报道,全球已知的仅有两例。
这种突变让她从不知疼痛为何物,也不会焦虑或害怕。由此付出的代价之一是,她会对吗啡产生恶心呕吐反应。所以一直以来,她抗拒使用麻醉药物,即便是面对一场大型手术——这吓坏了她的主治医生。
“他们觉得我在开玩笑。我说我真的不需要止痛药物,他们就问我是不是吃了什么神奇的东西。”
2013年,在接受一次手部手术时,医生警告说,那可是字面意义上的“刀割之疼”。但是,当看到乔若无其事地看着他们在她的手上切来切去的时候,医生们意识到他们遇到了一个医学奇迹。
他们把她送到了伦敦大学学院和牛津大学的疼痛遗传学家那里,进行了一系列的检查和测试。他们发现了一个罕见的基因突变,导致她的神经系统无法感知任何刺激。也就是在那个时候,乔总算明白了,为什么自己总是“非常健康”。

了不起的Jo Cameron女士 | 图源 :参考资料[1]
乔不是相对常见的先天性痛觉不敏症(CIP)患者。据估计,目前全球大概有数百人是CIP,他们可以把手放到沸水中或在没有麻醉的情况下进行手术,而不会感到任何疼痛。但CIP更像是一种诅咒,很多患者在童年时期,因缺少疼痛感,在某些需要身体感受的学习经历中,显得笨拙而迟缓,以至于被家人认为有智力上的残障问题。所以CIP患者在成年后,往往会出现心理上的问题。
但乔不一样。虽然大体上她也需要小心应对痛感缺失造成的危险预警失灵,但她从未因此沮丧,总能保持乐观和积极的心态——虽说这本质上属于基因层面的“作弊”。
“我以前从来没有想过我有什么不同。我就是不会感到疼痛而已。我也不会感到焦虑或恐惧。我觉得这是上帝给我的礼物。”
先天性痛觉不敏感是由一些基因突变导致的,这些基因突变影响了痛觉感知和传导的分子通道。目前已知的可以影响痛觉的(几种)基因突变包括:
Scn9a基因突变,导致电压门控钠离子通道Nav1.7功能缺失或异常,影响神经元的兴奋性和动作电位的产生。
Ntrk1基因突变,导致神经生长因子受体Trk-A功能缺失或异常,影响神经生长因子(NGF)在痛觉感知和传导中的作用。
Prdm12基因突变,该基因通常在痛觉神经细胞的发育过程中开启,Prdm12基因纯合突变的人会先天性无痛感。
Zfhx2基因突变,导致ZFHX2蛋白功能缺失或异常,影响神经元的转录调控。
但是,伦敦大学学院的疼痛遗传机制专家发现,乔的基因突变和上面这些都有所不同。经过6年的寻找,他们发现了一个新基因,他们将其命名为Faah-out(基因Faah则早已为人所知)。
乔的Faah-out包含了一种罕见的突变,它与Faah中另一种更常见的突变结合,是乔独特“症状”的成因。
“无痛”突变的分子生物学机制
通过乔·卡梅隆的“症状”,我们可以知道在表观上她所携带的突变有消除焦虑和恐惧、以及提高伤口愈合速度的功能。
对乔来说,罕见突变最大的价值是为她带来了美好的分娩体验:“那可是一次美妙的经历。我只是觉得有点紧张,然后就看到了我的宝宝。”
乔并不想改变自己,但她也知道疼痛自有其意义。
“疼痛是身体告诉你有问题的方式,没有它,你可能会错过很多重要的信号。比如说,我的髋关节就因为关节炎而彻底坏了。我都不知道它出了问题,直到我无法走路了。”
疼痛对于人类的生存和健康有重要的作用。疼痛是身体的一种警告机制,它可以让我们知道自己是否受伤或生病,并采取适当的措施。没有疼痛感的人可能无法及时发现和治疗潜在的问题,从而导致更严重的后果。疼痛也可以帮助我们学习如何保护自己,避免危险和伤害。没有疼痛感的人更容易做出冒险或自残的行为,例如赤脚走在热煤上或刺伤自己的手臂。
疼痛还可以让我们同情他人的苦难,增进人际关系和社会凝聚力。没有疼痛感的人可能难以理解他人的感受,由此缺乏同情心和同理心。
酸甜苦辣里面的辣,不是一种味觉,而是痛觉。乔曾与她的丈夫,以及她的麻醉师Devjit Srivastava医生一起参加辣椒挑战赛。两个男人辣得哭爹喊娘,乔则微笑着,泰然自若。
但疼痛也可以导致极大的痛苦,并影响生活质量。目前慢性疼痛起码影响着全世界数百万人,科学界迫切需要找到新的治疗方法。而确定新型镇痛策略的一条路径是,了解导致人类遗传性疼痛不敏感的生物功能障碍。
到2023年5月末,伦敦大学学院终于揭示了乔的罕见基因突变的分子生物学机制。
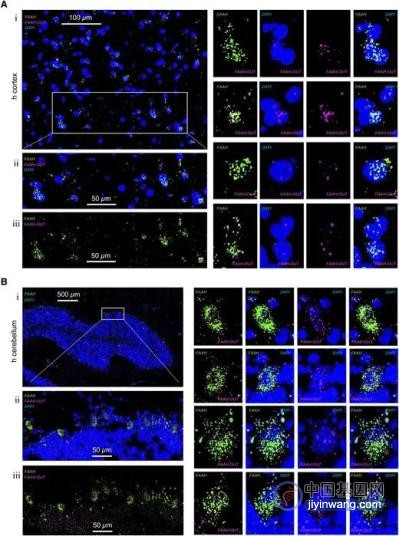
Faah和 Faah-out RNA在人脑组织细胞中的表达水平和定位。图源:参考资料[2]
(A) Faah和 Faah-out RNA 表达水平和在人大脑皮层细胞中的定位。通过RNAscope测定分析新鲜冷冻大脑皮层(7-10μM 厚)的切片,将 Faah mRNA(绿色,AF488)的定位与 Faah-out lncRNA(洋红色,Opal650)定位和指示细胞核位置的 DAPI 染色(蓝色)进行比较。比例尺为白色。代表性区域 (i) 和由白框指示的放大子区域显示绿色 (Faah) 和洋红色信号 (Faah-out) 与相同细胞 (ii 和 iii) 的共定位。右侧显示了表达 Faah mRNA(绿色)和 Faah-out lncRNA(洋红色)的单个细胞的放大图。
(B) Faah和 Faah-out RNA 表达水平和在人小脑细胞中的定位。通过 RNAscope 测定分析新鲜冷冻皮质切片(7–10μM 厚切块),将 Faah mRNA(绿色,AF488)定位与 Faah-out lncRNA(洋红色,Opal650)定位和指示细胞核位置的 DAPI 染色(蓝色)进行比较。代表性区域 (i) 和由白框指示的放大子区域显示绿色信号 (Faah) 和洋红色信号 (Faah-out) 与位于小脑叶外缘的相同大神经元细胞(浦肯野细胞)共定位( ii 和 iii)。右侧显示了表达 Faah mRNA(绿色)和 Faah-out lncRNA(洋红色)的单个细胞的放大图,证明 Faah mRNA 主要在细胞质中,而 Faah-out lncRNA 在细胞核中富集。
早先科学家常常将某些不编码蛋白质的基因或基因组区域称为“垃圾”基因,因为它们在基因表达中似乎没有直接的功能。包含Faah-out的基因组区域以前就被认为是没有功能的“垃圾”基因,但现在科学家已经认识到,基因除了直接指导蛋白质的生成之外,还可以调控其它基因组制造蛋白质的程序(也就是说,除了表达之外,基因其实还有调控的功能),而Faah-out恰恰能够调节Faah基因的表达,Faah基因是调控内分泌系统的基因的一种,还参与疼痛、情绪和记忆的调控。
发表在《Brain》上的研究揭示了Faah-out基因突变如何导致Faah基因表达下降,以及这对涉及伤口愈合和情绪的分子通路有何影响。研究者希望这些发现能够为新药的开发和该领域的进一步研究提供方向和目标。
具体而言,Faah-out基因是一个长非编码RNA(lncRNA)基因,它位于人类第一号染色体上,与基因Faah相邻。后者编码一种能够降解内源性大麻素类物质的酶,这些物质在痛觉、情绪等神经系统功能中起重要作用。最新的研究证实,Faah-out基因通过两种方式调节Faah基因的表达:Faah-out lncRNA转录中断会导致Faah启动子内依赖于Dnmt1的DNA甲基化;Faah-out 还包含一个调控元件 Faah-amp,它是Faah表达的增强子。增强子(Enhancer)是一种在基因调控中起关键作用的DNA序列,它能够影响附近或远距离的基因的表达。
由于乔·卡梅隆携带的突变,Faah-out基因的功能显著减弱,导致FAAH酶活性水平大幅降低。
此外,他们还发现Faah-out基因的突变导致另外797个基因被上调,348个基因被下调。其中一些基因涉及与伤口愈合相关的Wnt通路,特别是与骨骼再生相关的Wnt16基因。另外一些基因与情绪调节有关,如Bdnf和Ackr3,后者还被证明可以封闭内源性阿片肽,并被认为能调节其活性。在动物实验中,对Ackr3的抑制可增加阿片肽的活性,并产生镇痛和抗抑郁作用。
复杂的应用前景
这项研究的高级作者之一,伦敦大学学院医学院 (UCL Medicine) 的Andrei Okorokov博士说:“Faah-out基因不过是一个广阔未知领域的一个小角落,我们通过这项研究开始了对它的探索。我们不仅发现了无痛的分子机制,还发现了Faah-out突变对伤口愈合和情绪调控等分子通路的影响。作为科学家,我们有探索未知的责任,我相信这些发现将对治疗伤口愈合、抑郁等问题有重要意义。”
他们确定,Faah-out基因是一个内源性大麻素系统的新型调节器,它为治疗疼痛、焦虑、抑郁等神经系统疾病提供了新的靶点和策略。
“靶点”的意思是专门针对疾病的特定部分或分子进行治疗,就像我们在射击时专注于命中目标一样。这种方法旨在更精确地影响疾病,减少对正常组织的伤害。通常,医生们会寻找疾病中的关键分子或生物过程,然后开发药物或治疗方法,针对这些关键点进行作用,以达到更好的治疗效果。这种方式与传统的广谱疗法相比,更能降低副作用,提高治疗的效果。
那新研究是否意味着,我们未来将有一种新型的靶向Faah-out基因的止痛和抗焦虑药物?
这里的情况有点复杂。前文提到过,Faah基因的功能是我们早已知道的。医药研发企业曾试图制造直接靶向Faah的药物BIA 10-2474,后果非常著名,BIA 10-2474直接被写入了教科书:它在一期临床就造成了人类实验者的死亡!
BIA 10-2474是实验性的脂肪酰胺水解酶(FAAH)抑制剂,被认为具有治疗疼痛和其它疾病的潜力。2016年1月,这种药物在法国进行的人体一期临床(FIH)中导致了一场灾难,一名连续5天接受了50毫克剂量的健康志愿者死于严重的脑微出血(后果包括深部出血和坏死性病变),另外四名连续6天接受同样剂量的志愿者也出现了神经系统损害的症状。这是有史以来第一次在FIH试验中出现如此突然和严重的不良事件。
在动物毒性试验中,BIA 10-2474也引起了多种不良反应,主要包括神经系统、消化系统、血液系统、肝脏、肾脏、肺部和睾丸等器官的损害。但损害主要出现在较高剂量(500毫克/公斤体重/天)或较长时间(13周或26周)的给药后。然而,动物试验中出现的副作用与人体试验中出现的致命事件并无直接或明显的联系。尤其是,在动物试验中没有观察到任何类似于脑微出血或卒中等严重神经系统损害的表现。
对比可见,人体试验中的悲剧是无法预测和解释的,也没有任何已知的机制可以合理地说明这种毒性。
靶向Faah基因的药物造成未知的后果,说明存在我们尚未摸清的机制。目前我们不清楚,选择不直接靶向Faah,转而瞄准与之对应的Faah-out基因,到底是避免悲剧的正确路线,还是另一条通向叵测未来的歧路。
参考文献
[1] https://www.ucl.ac.uk/news/2023/may/study-reveals-unique-molecular-machinery-woman-who-cant-feel-pain
[2] https://academic.oup.com/brain/advance-article/doi/10.1093/brain/awad098/7169317
[3] Open letter on access to the BIA 10-2474 clinical trial data - The Lancet
[4] Full article: Non-clinical toxicology evaluation of BIA 10-2474 (tandfonline.com)
[5] Scientists in the dark after French clinical trial proves fatal | Nature
[6] https://www.bbc.com/future/article/20170426-the-people-who-never-feel-any-pain
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。