国外基因治疗各阶段挑战来袭,国内追捧也逐渐火热
作为一种可以替代传统疗法的新兴治疗方式,基因治疗的优势在于在基因层面从根治愈疾病,能够精准打击疾病根源--异常DNA,是一种根本性的治疗策略。细胞基因治疗刚需强烈,适应症以单基因遗传病(罕见病)和恶性肿瘤为主,这类疾病的致病基因明确,同时缺乏有效的治疗手段,面临巨大的未满足临床需求。
近年来,以细胞和基因治疗药物为代表的新型药物和新型疗法兴起,基因治疗药物研发已经成为并且将继续成为最受关注的制药领域之一,引众多药企都想要来“分一杯羹”。在技术、资本和政策的驱动下,全球基因治疗行业快速升温,大量基因治疗药物研发进入临床阶段,并自2015年起呈现爆发式增长。根据ASGCT(AmericanSociety of Gene+Cell Therapy,美国权威的细胞和基因治疗协会)的数据,截至2021 年底,全球累计在研基因治疗临床试验超过1745项。
01
“最贵”的药物
由澳大利亚制药公司CSL Behring开发的Hemgenix是一种一次性基因治疗产品,由携带凝血因子IX基因的病毒载体组成。该基因在肝脏中表达以产生因子IX蛋白,增加因子IX的血液水平,从而限制出血发作。Hemgenix使用AAV5载体递送表达凝血因子IX Padua变体的转基因,这种变体比普通凝血因子IX的活性要强5-8倍,可以在更低的表达水平完成正常凝血功能。
据临床实验数据,Hemgenix的安全性和有效性在两项针对57名18至75岁患有重度或中度B型血友病的成年男性的研究中得到了评估。另外,在一项有54名受试者的研究中,受试者的因子IX活性水平增加,可以减少凝血因子IX的预防性治疗,年出血率(ABR)与基线相比降低了54%。接受一次注射后,94%的受试者得以免除终生凝血因子注射。
这是全球首个针对B型血友病的基因疗法。

而就在今年的8月,欧盟委员会(EC)批准BioMarin Pharmaceutical用于治疗A型血友病的基因疗法Roctavian(valoctocogene roxaparvovec)附条件上市,用于治疗严重A型血友病成人患者。这是全球首款获批治疗A型血友病的基因疗法,据悉,Roctavian的定价预计在每次治疗200万-300万美元之间。
基因疗法在血友病的治疗中首先突破,这是全球所有血友病患者之幸。然而,这两个基因疗法的价格不知道会不会也同时让这些患者感到绝望。
“昂贵”几乎已成为基因治疗的代名词。
由Spark Therapeutics公司研发用于治疗RPE65基因突变导致的Leber先天性黑朦(LCA)的基因疗法注射剂Luxturna单价为42.5万美元,双眼治疗费用为85万美元;
由Novartis Pharma AG公司研发的用于治疗脊髓性肌萎缩的AAV基因疗法产品Zolgensma年治疗费用约212万美元;
由Bluebird推出的用于治疗β-地中海贫血患者的基因疗法产品Zynteglo,定价280万美元;用于减缓4-17岁早期活动性脑肾上腺脑白质营养不良(CALD)男孩神经功能障碍的进展的基因疗法产品Skysona,定价300万美元。
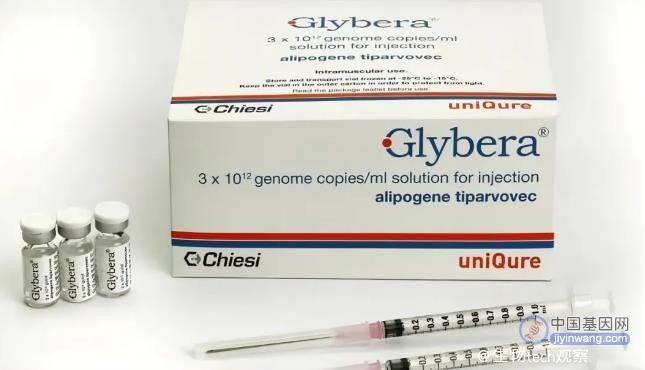
如此高昂的费用,真让人为这些基因疗法的商业化捏一把汗。2014年,欧盟首款基因疗法Glybera获批上市,由荷兰生物技术公司UniQure开发,用于治疗罕见遗传病脂蛋白脂肪酶缺乏症,该药物将脂蛋白脂肪酶基因插入肌肉细胞。但是由于该病发生在极少数患者中(发病率仅为百万分之一),且售价高达100万美元,一度成为全世界最昂贵的药物,上市后仅售出一例。2017年,在Glybera上市4年后,UniQure公司决定将其退市。
在中国,第一款获批上市的CAR-T细胞疗法产品瑞基奥仑赛由于定价129万元/针,且完全自费,注定不是多数家庭能承受的数字。2022年上半年,药明巨诺总营收仅有6600万元,商业化成绩与当初上市的招股说明书预期完全不一致,这也导致了其股价的大幅下跌。
事实上,基因疗法除了商业化的挑战之外,在基础研究中,也还没有完全成熟,尚处于技术发展的初级阶段,基因治疗领域还有诸多问题等待被攻破。
02
尚待突破的挑战
基因治疗的出现并不久远。1971年,一项科学实验表明,可以将DNA注射到人体细胞中以解决这些细胞中的生物学问题。1972年,一篇发表在《Science》杂志的文章中首次提出,使用基因疗法作为治疗人类遗传疾病的手段。
科学家首次在临床试验中使用基因疗法则始于1980年代后期。直到1990年代初,研究人员才开始报告这些试验结果。大多数基因疗法针对的是遗传性疾病,也可以用来治疗某些癌症和病毒感染。
目前基因疗法分为两种方式。包括对患者抽血,在实验室中提取特定细胞进行基因编辑,然后将“治愈”的细胞重新注入人体,这是较为常用的方法;第二种是将基因直接靶向递送到体内,这项技术正不断发展与成熟。
所以目前基因疗法已经分化成为一个大类,基因治疗药物包括被批准的质粒DNA、反义寡核苷酸、小干扰RNA-脂质复合体、病毒以及遗传工程细胞治疗产品等。
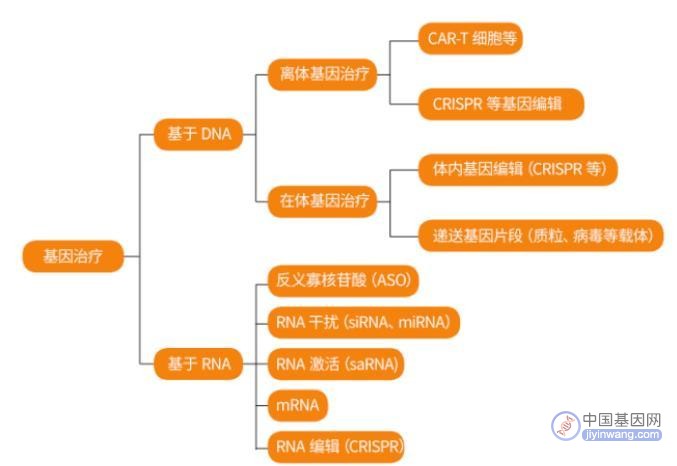
但是在技术发展的过程中,难免会碰到挫折。
2020年8月,日本制药公司安斯泰来的子公司Audentes Therapeutics宣布在其研究的AT132基因疗法临床试验中出现了第三起死亡事件。该患者参加了Audentes的罕见神经肌肉疾病XLMTM(X连锁型肌管肌病)基因治疗试验,在接受了高剂量的以AAV8(8型腺相关病毒)为载体的药物治疗一段时间后死亡。
在不到五个月的时间里,基因治疗领域又遭遇了两次挫折。2020年12月,UniQure的一项针对B型血友病的基因疗法被美国FDA叫停,起因是接受治疗后该患者患上了肝细胞癌;2021年1月,致力于罕见病精准医疗的Sarepta公司在披露一项关键研究没有达到其中一项主要目标后,其治疗杜氏肌营养不良症的最佳方法也面临着重大质疑。
总结来看,基因治疗主要面临三个难题。
一是药物传输送为主要技术障碍。在最小化毒性和免疫原性问题的前提下,生产商仍难以确定将疗效输送到靶组织的最佳剂量。
二是生产和供应链为主要的阻力。基因疗法生产复杂,仍需要人工操作,在细胞和基因疗法领域占主导地位的小型生物科技公司仍非常依赖于外部供应商,导致成本十分高昂。
三是基因疗法的效果仍然充满了不确定性。现实中,科学家们还在努力应对基因疗法持久性的相关挑战,这也引发了基因疗法是否真的能够“治愈”疾病的疑问。
不过尽管如此,基因治疗领域的投资热度依旧非常火爆。据统计,在2021年,基因治疗行业的投资总额达到了约115亿美元。在国内,对基因治疗的追捧也逐渐火热。
03
国内基因治疗起步期
今年国内基因治疗领域融资事件数创新高,临床试验获批数创新高。截至11月底,国内约12个基因治疗药物临床试验申请获批,明年将开展大量临床试验,详见之前推送的文章国内基因治疗公司全盘点。
除了今年新申请临床试验的药物,还有一些进度更靠前的基因治疗药物明年或将有更多临床数据。
纽福斯首发产品治疗ND4突变引起的Leber遗传性视神经病变,今年已进入临床3期。
信念医药首发产品治疗血友病B,于2021年进入临床试验阶段, 今年该药被CDE纳入突破性治疗品种、获FDA孤儿药认定,IIT试验结果正式发表于《柳叶刀-血液病学》。
博雅辑因首发产品治疗输血依赖型β地中海贫血,于2021年进入临床试验阶段。
结语
经过多年探索,国外基因治疗市场逐渐打通,多个基因治疗药物获批以及更多药物等待获批,已有“量产”趋势。如果这一批基因治疗药物的上市、商业化路径畅通,将会吸引更多资金、人力,形成一个完美循环。而国内基因治疗公司刚起步,明年是关键的起步期,预计到后年才会有青涩果实收获。
抓住这些关键节点,可能迎来惊喜。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。