基因编辑的时代是否已经到来?目前还远未到黎明!
“2023年末,首款基因编辑药物Casgevy(exagamglogene autotemcel,exa-cel)在英国和美国相继获批,用以治疗12岁及以上患者的镰刀型贫血症(Sickle Cell Disease)。Casgevy采用体外细胞基因编辑的方式,将镰刀型贫血症患者的血液干细胞取出,在关键的BCL11A基因位置进行CRISPR/Cas9编辑,敲低该基因后,再将改造后的干细胞重新输入回患者体内。编辑后的干细胞可以大量产生胚胎血红蛋白(HbF),HbF可以提高携带氧气的能力,并防止红细胞变为镰刀型,进而治愈镰刀型贫血症。
相信不少读者还记得贺建奎在编辑胚胎细胞的道德和伦理风险,那这次国外获批的基因编辑疗法为何可以一路走通,直至上市呢?”
01 引子
此基因编辑非彼基因编辑
首款获批的基因编辑药物Casgevy采用的是一种体外基因编辑(Ex vivo)的方法,将镰刀型贫血症患者的干细胞取出,体外改造并测试后,重新输入回体内,发挥生成胎儿血红蛋白的功能。这种“提取细胞-体外编辑-重新回输”的治疗方案在肿瘤领域CAR-T治疗已经进行了较为充分的验证,对于患者安全有保障,而且体外编辑后可以检测是否脱靶,也避免了CRISPR脱靶的“隐疾”。
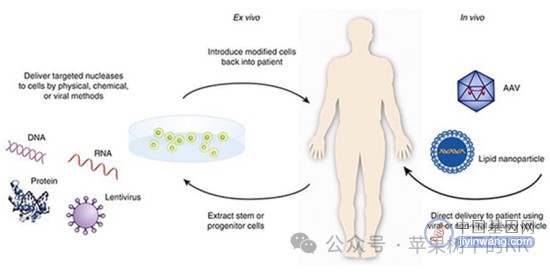
相比较而言,基因编辑胚胎细胞的风险则大得多。被编辑的胚胎细胞,之后会持续分裂、分化,最终成长为一个活生生的人。如果编辑的基因位置不准确或者对于被编辑的基因在人类生长过程中的认识不够深入,很可能会导致“基因编辑人”后续出现各种意向不到的状况或疾病,这对于生命是极其不负责任的。
所以说基因编辑技术本身并无所谓的优劣,将该技术应用于何种领域才是关键。倘若应用于伦理风险极高的胚胎编辑,会引起学术及社会的广泛批评,但是应用于镰刀型贫血症的治疗则给病人带来了新的希望。那么镰刀型贫血症作为一种罕见遗传病,为什么成为了CRISPR基因编辑最早的应用场景呢?
02 疾病
为什么是镰刀型贫血症
镰刀型贫血症是一种遗传性的血液疾病(inherited blood disorders),发病人数约440万,死亡人数约11.5万(2015年数据),主要在非洲人群中流行,西班牙人群中也有少量发生。镰刀型贫血症患者主要表现为携带氧气的红细胞外形由一般红细胞的圆盘形变为镰刀形状,更容易聚集并阻塞血管,引起血管阻塞危象(vaso-occlusive events, VOEs),造成严重的疼痛和器官损伤,最终可能导致残疾或死亡。
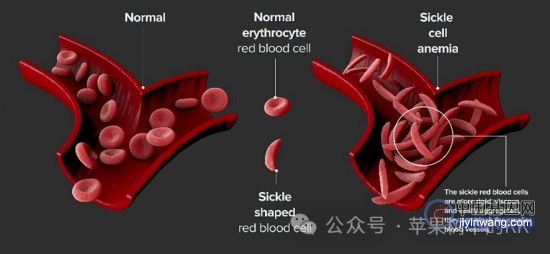
那么为什么基因编辑技术最开始用在镰刀型贫血症上呢?最主要的原因是该疾病是世界上最早发现分子病理的疾病,致病机理最为清晰。
20世纪初,人们认识到镰刀型贫血症是一种常染色体隐形遗传病。1949年著名化学家Linus Pauling(就是发明化学键概念的那位大佬,也是来鲁华教授的导师)在Science发文,揭示了镰刀型贫血症的分子病因。鲍林将正常人、患者和携带者的血红蛋白进行电泳,发现正常人和患者的电泳图明显不同,但是携带者的电泳图与正常人+患者1:1混合配成的混合物电泳图非常类似。这说明携带者的血红蛋白已经是杂合状态。
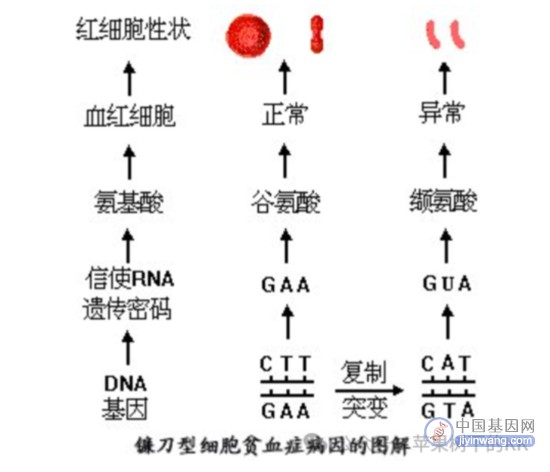
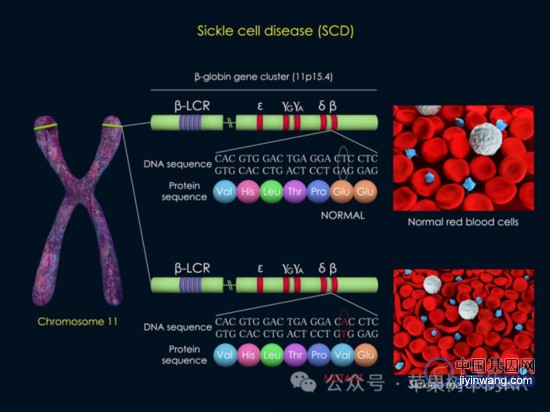
后经结构解析,正常的血红蛋白是由两条α链和两条β链组成的四聚体,每条肽链都以非共价键与一个血红素链接。α链由141个氨基酸组成,β链由146个氨基酸组成。1956年,Vernon Ingram在Nature发文,将正常血红蛋白HbA和镰形血红蛋白HbS在相同条件下酶切,对比二者的电泳谱图,发现仅有β链的N末端有一个肽段不同。经过确认,该位置的谷氨酸突变后变为缬氨酸,致使该区域水溶性下降,血红蛋白HbS形成管状凝胶结构,最终导致红细胞扭曲变为镰刀状。后来的研究结合中心法则的编码规则,确认镰刀型贫血症的病因在于编码血红蛋白β链的基因发生单一碱基突变,该基因位于11号染色体上,编码β链的基因由CTT突变为CAT,导致转录mRNA的第六个密码子由GAG(编码谷氨酸)突变为GTG(编码缬氨酸),进而导致血红蛋白由正常的HbA变为突变的镰形血红蛋白HbS,最终导致血细胞由圆盘形变为镰刀型。
对于这样一种基因突变引起的恶性疾病,早期的治疗手段很有限,包括抗癌药物羟基脲hydroxyurea,输血,骨髓移植等。其中Hydroxyurea使用较为广泛(1998年获批治疗镰刀型贫血症),其主要作用为诱导激活γ链产生,用以替代突变的β链,这样形成的血红蛋白类似于胎儿血红蛋白HbF。虽然使用Hydroxyurea不能治愈镰刀型贫血症,临床上也有增加急性白血病(acute leukemia)等副作用,但是该药物可以帮助减轻疾病症状,而且治疗逻辑为基因编辑治疗贫血症趟出了一条可行之路。
03 治疗
基因编辑是如何发挥魔力的?
既然搞清楚了镰刀型贫血症的起因是十一号染色体中编码谷氨酸的基因有单碱基突变,那么是不是将碱基编辑回正常基因就可以实现疾病治愈了呢?
答案并非如何简单直接,目前的CRISPR/Cas9系统在沉默方面比修复也更有效,同时如果删去突变的核苷酸会进一步损坏血红蛋白。另外在患有该疾病的患者身上很难实现全部编辑造血干细胞,而编辑胚胎伦理风险过大。这仿佛给人们浇了一盘冷水:致病机理搞得如此透彻,但是如何解决这个问题又变得棘手。
临床的观测给人们一些治疗启发。临床上,镰刀型贫血症患者的严重程度并非完全一致,有些患者表现很严重,而有些患者很轻,决定严重程度的是胎儿血红蛋白(fetal hemoglobin, HbF)的浓度高低。一般情况下,胎儿血红蛋白HbF在新生儿出生6个月内会产生,6个月后不再生成HbF,转而生成HbA,该过程称为hemoglobin switching。但是极少一部分人会持续生成HbF,这部分人如果患有镰刀型贫血症,临床表现很轻微,而且这部分人群并无其他副作用。这个临床观察提示,使用HbF作为替代的血红蛋白,可能是一种有效的治疗镰刀型贫血症的方法。而上市药Hydroxurea使用后也是诱导产生HbF,从而缓解症状,如果可以自发诱导HbF的产生是否就可以治愈镰刀型贫血症呢?
实现这一点就需要找到控制HbF产生的那个“开关”。这个问题在21世纪初人类基因自计划后得到解决机会。利用基因组学,尤其是全基因组关联研究(genome-wide association study),人们终于找到了控制HbF的开关。2008年来自波士顿儿童医院Stuart Orkin在Science发表文章发现了关键的基因BCL11A(位于染色体2p15)是提高HbF的关键因素。BCL11A编码的蛋白是一个锌指蛋白,研究发现HbF高表达的人群中,BCL11A的表达很低,而BCL11A蛋白的表达局限于成人红细胞内。这说明胎儿发生的6个月时HbF表达降低很有可能是因为BCL11A开始表达。那么如果将BCL11A进行抑制,是否就可以提高HbF的表达,因而治愈镰刀型贫血症了呢?答案是积极的,在人类初代红细胞中下调BCL11A的表达,可以极大提高HbF蛋白的生成!
Stuart Orkin in his lab at Boston Children's Hospital in 1985
此后,Orkin实验室进一步尝试在动物上将BCL11A基因敲除。但是基于敲除BCL11A的治疗策略还需进一步完善:如果将所有细胞的BCL11A都敲除,将会引起很大的问题,例如骨髓瘤细胞需要BCL11A基因表达来生成红细胞。所以要限制敲除仅发生在红细胞中。终于在2013年,Orkin实验室发现了BCL11A的增强子可以作为敲除靶标,使用上一代基因编辑技术TALEN移去BCL11A的增强子后,BCL11A几乎完全不表达,这种编辑后的红细胞可以大量产生HbF。
随后Orkin和MIT的张锋教授合作,使用更先进的CRISPR/cas9基因编辑系统,对BCL11A的enhancer区域筛选测试,设计了高效的guide RNA用于引导CRISPR系统至enhancer区域,最终切除enhancer,沉默BCL11A。该研究于2015年发布于Nature。
此时Orkin认为将这一疗法进一步开发应该落在药企身上,因为大药企推进临床更快速。因而Orkin促进了这项技术的非独家授权,这样很多gene editing公司都可以使用,包括CRISPR、Editas、Intellia、Sanagmo和Vertex等。
这一领域跑得最快的是CRISPR和Vertex的合作,在2019年,二者合作开发的Casgevy开始人体临床试验,测试患者体内是否可以通过编辑BCL11A的enhancer来治愈镰刀型贫血症。最终临床试验结果表明,几乎所有接受Casgevy的患者都不怎么疼痛,且血管阻塞危象的得到显著降低。
04 未来
基因编辑的时代是否已经到来?
作为CRISPR小试牛刀的镰刀型贫血症,背后的故事一波三折。历经艰险后,终于Casgevy获得批准。这是否意味着基因编辑的时代就此来临呢?
对于这个问题我是个长期乐观主义者,基因组的信息、基因表达的调控最终肯定会带来人类面对疾病的更大突破。但是现阶段基因编辑时代的来临至少要解决以下几个问题:
(1) 基因导致的疾病生物学能否越来越清晰?可以发现镰刀型贫血症(包括地中海贫血症)的疾病机理经过约半个世纪的研究终于清晰。但是很多疾病的发病机制并非完全来自基因突变。例如肿瘤、心血管疾病等。对于这些疾病的发病机制如果可以有进一步的明晰,将会给基因编辑药物带来更广的靶点范围。
(2) 基因编辑的成本能否大幅降低?目前Casgevy需要提取从患者骨髓提取干细胞,体外编辑和培养,过程繁琐复杂且很贵,类似CAR-T疗法,Casgevy的价格注定不会便宜。(美国最新定价220万美金)。而镰刀型贫血症的主要发病人群在非洲,经济落后使得最新批准的Casgevy基本无力承担。如何发展便宜的体外基因编辑疗法将是促进更广泛群体使用的关键。
(3) 基因编辑技术修复能力能否继续提高,是否可以做到体内靶向。目前CRISPR的编辑能力主要在敲降,且脱靶问题不容忽视。新一代的编辑系统,包括primer-base editing,将在编辑准确度上更进一步。另外,体外细胞编辑步骤繁琐,如果可以体内编辑将会扩大疗法的顺应性。这方面,Intellia的LNP递送系统可能有较好的前景(靶向TTR),至于肝外细胞靶向则需要更进一步探索。
总之,基因编辑的时代终将到来,但是目前还远未到黎明。
吾辈仍需努力!
参考:
1 https://news.vrtx.com/news-releases/news-release-details/vertex-and-crispr-therapeutics-announce-authorization-first
2 https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease
3 https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/what-gene-therapy
4 https://endpts.com/how-one-labs-decadeslong-search-for-the-holy-grail-of-sickle-cell-led-to-the-first-crispr-therapy/
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。







![基因测序行业深度研究报告:未来大健康领域黄金赛道[共77页] 基因测序行业深度研究报告:未来大健康领域黄金赛道[共77页]](/static/upload/other/20230126/1674744324488315.jpeg)