2022年基因治疗领域发展态势
导读
基因治疗是指通过修饰或操纵基因的表达,或改变活细胞的生物学特性,以达到治疗疾病的目的。基因治疗已成为生物医药领域继小分子、大分子之后的一条热门新赛道。本文对2022年全球基因治疗领域的政策规划、研究进展进行了总结。分析发现,载体递送及基因编辑等技术的突破加速基因治疗发展,基因治疗应用愈加广泛,适应证已从遗传病扩展到癌症、心血管疾病等领域,获批产品不断增多,基因治疗产业化加速发展。此外,本文也对基因治疗发展趋势进行了展望。
2022年基因治疗领域发展态势
基因治疗是指通过修饰或操纵基因的表达,或改变活细胞的生物学特性以达到治疗或预防疾病的目的。基因治疗萌芽于20世纪60年代,90年代开始步入临床阶段;直到21世纪初,随着基因组测序的快速发展,病毒及非病毒载体技术的进步以及基因治疗安全性的提升,基因治疗开始逐渐取得突破,进入高速发展阶段。此后,CRISPR等突破性技术的不断涌现进一步丰富了基因治疗技术体系,为基因治疗的发展带来了新契机。近年来基因治疗快速发展,已成为生物医药领域继小分子、大分子后的一条新赛道。目前全球已有10余款基因治疗产品上市,尤其是2022年,4款产品迎来全球首批,且均为相应适应证的首个基因治疗药物。基于CRISPR的基因编辑疗法在2022年也快速步入上市申请阶段。从疾病角度来看,2022年的多项研究进展证明了基因治疗不仅具有一次性治愈遗传性疾病的潜力,还为糖尿病、心血管疾病等疾病的治疗提供新的治疗理念和手段。
1 全球基因治疗相关规划
全球生物医药产业蓬勃发展,基因治疗作为生物医药的重要新兴领域,已成为全球多个国家/地区战略规划布局的重点。2022年,美国通过新机构、新计划对基因治疗进行了多方位资助。美国高级健康研究计划局(The Advanced Research Projects Agency for Health, ARPA-H)成立,将支持提高药物或基因治疗载体靶向性的分子研究。基因治疗作为美国《国家生物技术和生物制造计划》的重要组成部分被列入多个资助机构的规划中,如美国生物制药制造创新机构(National Institute for Innovation in Manufacturing Biopharmaceuticals, NIIMBL)将启动计划以促进基因疗法等相关生物制造技术的转化,美国国立卫生研究院(National Institutes of Health, NIH)将支持罕见病基因治疗临床试验等。美国白宫还通过重启“癌症登月计划”支持癌症相关基因治疗研究。欧盟通过“研发框架计划”、“健康欧盟计划”及“创新药物计划(Innovative Medicines Initiative, IMI)”等长期支持基因治疗研究。法国的“生物治疗和创新治疗用生物制品”加速战略重点部署基因治疗的研究与开发。印度科技部发布《2021—2025年国家生物技术发展战略:知识驱动生物经济》(Nation Biotechnology Development Strategy (2021-2025)),也提出对基因编辑和基因疗法等进行优先资助。巴西卫生部将投资1 500万雷亚尔建立科学、技术和创新机构,促进基因治疗、先进细胞治疗等的开发。
2 基因治疗研发进展
2022年基因治疗在不同适应证的应用研发、基于基因编辑技术的基因治疗、载体递送技术等方面持续取得重要进展。截至2023年1月,ClinicalTrials.gov数据库收录了656项正在进行或已完成的基因治疗相关临床试验[i](图1)。全球已有12款产品获批上市(表1)。从临床试验及获批产品的适应证上来看,基因治疗主要在代谢、血液、眼部及神经系统等领域的遗传病中取得重要进展。
[i] 不包括CAR-T细胞治疗及TCR-T细胞治疗等纳入免疫细胞治疗的临床试验统计数据。
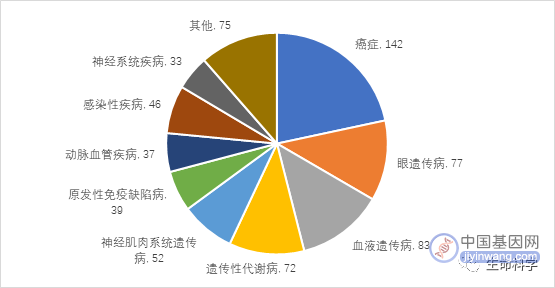
图1 基因治疗临床试验适应证分布情况
表 1全球已获批基因治疗产品
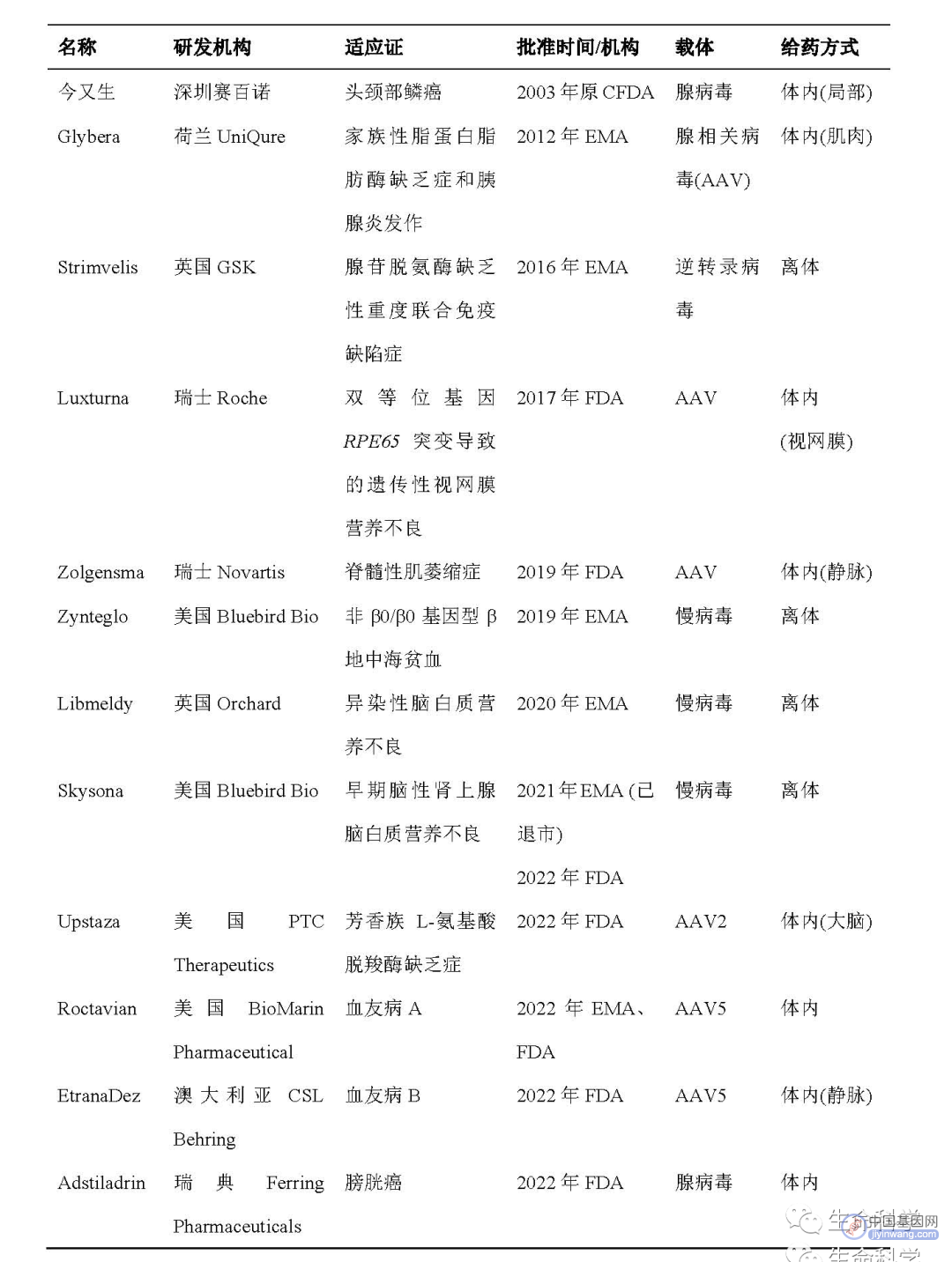
注:CFDA,原国家食品药品监督管理总局;FDA,美国食品药品监督管理局;EMA,欧洲药品管理局
2.1 不同适应证基因治疗研发进展
2.1.1 遗传性代谢病基因治疗研发进展
从获批产品来看,针对遗传性代谢病已有4款产品上市,包括2012年欧洲药品管理局(European Medicines Agency, EMA)批准的首个基因治疗药物Glybera,以及早发型异染性脑白质营养不良(MLD)基因疗法药物Libmeldy、早期脑性肾上腺脑白质营养不良(ALD)基因疗法药物Skysona和芳香族 L-氨基酸脱羧酶(AADC)缺乏症基因疗法药物Upstaza。其中,由荷兰UniQure公司研发的用于治疗家族性脂蛋白脂酶缺乏症的Glybera与美国Bluebird Bio公司研发的Skysona均由于巨额的医疗费用及市场需求等原因退出欧洲市场,但Skysona于2022年9月获得美国FDA的批准在美国重新上市。此外,2022年7月获EMA批准上市的Upstaza是首个直接注入大脑的基因疗法,该疗法是通过AAV2载体直接向患者脑内递送缺乏的多巴脱羧酶(dopa decarboxylase, DDC)基因。针对其他遗传性代谢病的基因疗法也在不断开发中,美国马萨诸塞州立大学Chan医学院等机构利用两种AAV载体将分别编码HexA酶两种不同亚基的基因经鞘内注射递送至2名患有由HexA酶缺乏引起的泰-萨克斯病(Tay-Sachs disease)的儿童体内,成功改善了疾病症状[1]。2022 年,上海天泽云泰生物医药有限公司(天泽云泰)自主研发的用于治疗戊二酸血症Ⅰ型(GA-I)的VGM-R02b和治疗神经病变型戈谢病(nGD)的VGN-R08b先后获得美国FDA授予的罕见儿科疾病认定(rare pediatric disease designation, RPDD),其中VGM-R02b是全球首个用于GA-I治疗的基因治疗产品。
2.1.2 血液遗传病基因治疗研发进展
在血液遗传病领域,全球首个基因治疗药物为美国Bluebird Bio公司开发的Zynteglo,该药于2019年获EMA批准上市,用于治疗β地中海贫血;2022年8月,该产品在美国也获批上市。治疗血友病的基因疗法在2022年取得重要进展,两款产品相继获批上市。8月,由美国BioMarin Pharmaceutical公司开发的基因治疗药物Roctavian获EMA有条件批准上市,成为全球首个针对血友病A的基因疗法;11月,全球首个血友病B基因治疗产品也获得美国FDA批准上市,为荷兰UniQure公司/澳大利亚CSL Behring 公司开发的药物EtranaDez。Roctavian和EtranaDez均利用AAV5载体向体内分别递送编码凝血因子Ⅷ和Ⅸ的功能性基因。针对血友病B,我国上海信致医药科技有限公司(信念医药科技)、天泽云泰和四川至善唯新生物科技有限公司开发的基因治疗产品已获批进入临床。其中,信念医药科技自主研发的BBM-H901是我国首个获批进入临床的血友病B基因治疗产品。BBM-H901的安全性和有效性已在一项研究者发起的临床试验(investigator-initiated clinical trial, IIT)中得到验证[2]。随后,另一项研究显示,一名接受BBM-H901治疗的患者还成功进行了膝关节置换手术,术中无补充外源凝血因子Ⅸ[3],该研究进一步证实了BBM-H901对血友病治疗的有效性。基于优异的疗效,该产品已分别获得美国FDA孤儿药资格认定和我国国家药品监督管理局(National Medical Products Administration, NMPA)突破性治疗药物资格。
2.1.3 眼遗传病基因治疗研发进展
由于眼部的相对免疫豁免特性及所需药量较小等原因,眼遗传病也是基因治疗研发的一个重要方向,目前的适应证主要包括遗传性视网膜营养不良症(IRD)、视网膜色素变性(RP)、无脉络膜症(CHM)、Leber遗传性视神经病变(LHON)、Leber先天性黑蒙(LCA)等。2017年,美国FDA批准了首个用于遗传性视网膜疾病的基因治疗药物Luxturna,通过直接向视网膜注射Luxturna治疗由双等位基因RPE65突变导致的IRD患者。针对该适应证,上海朗昇生物科技有限公司的LX101和方拓生物科技有限公司的FT-001于2022年已分别获得我国NMPA临床试验许可,且FT-001 的临床试验申请还获得了美国FDA许可,目前在国内已完成首例患者给药。法国GenSight Biologics公司开发的Lumevoq是一款用于治疗由ND4线粒体基因突变引起的LHON的基因治疗药物,其采用rAAV2/2载体向体内递送ND4基因;最新5年随访结果数据显示,患者在接受一次性治疗后,耐受性良好且视力明显改善。目前,该公司已向EMA提交上市申请,此前Lumevoq已获得法国临时使用授权。武汉纽福斯生物公司开发的NR082也是针对该适应证,已进入临床Ⅲ期,2022年1月还获得了FDA的新药临床研究申请许可,是我国首个获得FDA临床试验许可的眼科基因治疗药物。另外,针对CYP4V2基因突变导致的结晶样视网膜变性,2022年,天泽云泰的VGR-R01和北京中因科技有限公司的ZVS101e已先后获批进入临床。除遗传性眼病外,基因治疗也为年龄相关性黄斑变性(AMD)提供了新疗法,成都弘基生物科技有限公司(康弘药业子公司)的KH631已先后获得中美临床许可用于治疗湿性AMD (wet-AMD)。
2.1.4 神经肌肉系统遗传病基因治疗研发进展
在神经肌肉系统疾病领域,目前主要针对脊髓型肌萎缩(SMA)、进行性假肥大性肌营养不良(DMD)、庞贝病(Pompe disease)、肢带型肌营养不良(LGMD)等进行基因治疗产品的开发。2019年,美国第二款基因治疗药物Zolgensma上市,用于治疗2岁以下患有由SMN1等位突变导致的脊髓性肌萎缩儿童患者。2022年1月,该产品在中国获得临床试验默示许可;4月,已启动Ⅲ期临床试验。2022年6月,我国首个针对该疾病自主研发的基因治疗产品也获得NMPA批准进入临床,为杭州嘉因生物科技有限公司自主研发的EXG001-307。此外,北海康成制药有限公司与美国马萨诸塞州立大学Chan医学院正合作开发用于治疗脊髓性肌萎缩的新型第二代AAV基因疗法scAAV9-SMN1p-co-hSMN1,在2022年美国基因与细胞治疗学会(ASGCT)上公布的动物试验研究数据显示,与基准载体基因疗法相比,该产品表现出更好的安全性和有效性。2023年1月,北海康成制药有限公司已从美国马萨诸塞州立大学Chan医学院获得该疗法的全球独家授权。进行性假肥大性肌营养不良(DMD)也将有望迎来首个基因治疗药物,美国Sarepta Therapeutics公司/瑞士Roche公司开发的基因疗法SRP-9001上市申请已获得FDA优先审评资格,SRP-9001以AAVrh74为载体将编码微营养不良蛋白(micro-dystrophin)的基因递送到肌肉组织细胞以达到治疗效果。此外,美国Solid Biosciences公司研发的以AAV9为载体的SGT-001目前也正进行用于DMD的Ⅰ/Ⅱ期临床试验。庞贝病分婴儿型庞贝病(infantile onset Pompe disease, IOPD)和晚发型庞贝病(late onset Pompe disease, LOPD),目前国际上主要针对LOPD进行基因治疗产品的临床开发,如日本Astellas Pharma公司的AT845和瑞士Roche公司的SPK-3006;北京锦篮基因科技有限公司则开展了国际上首个AAV静脉注射治疗IOPD的临床研究,相关产品GC301已完成首例患者给药。
2.1.5 遗传性耳聋疾病基因治疗研发进展
遗传性耳聋也是基因治疗的潜在应用领域。OTOF基因突变是引起遗传性耳聋的一大原因,由于OTOF基因过大超过单个AAV载体载荷,因此当前开发的基因疗法多采用双AAV载体策略。针对该疾病,2022年,美国Akouos公司(被美国礼来公司收购)和Decibel Therapeutics公司分别开发的基因疗法AK-OTOF和DB-OTO先后获FDA批准进入临床,法国Sensorion公司的OTOF-GT也获得了FDA孤儿药资格认定。2022年11月,上海鼎新基因科技有限公司与复旦大学附属眼耳鼻喉科医院合作启动国内首个用于治疗耳聋的基因疗法临床试验,其开发的基因疗法RRG-003也采用AAV双载体将药物递送至耳蜗内,恢复或改善OTOF突变耳聋患儿的听觉和语言功能,目前已完成首例患者给药。
2.1.6 其他疾病基因治疗研发进展
除遗传性疾病外,通过向体内递送各种功能性基因,基因治疗逐渐在癌症、传染病及其他常见病等非遗传性疾病中开辟出新的道路,基因治疗的潜力将得到极大拓展。从适应证来看,全球首个获批的基因治疗产品并非用于遗传病而是癌症。2003年,我国率先批准了世界上首个基因治疗产品——重组人P53腺病毒注射液(今又生),该药由深圳市赛百诺基因技术有限公司研发,用于治疗头颈部鳞状细胞癌。时隔近20年,另一款用于癌症的基因治疗药物Adstiladrin成功获FDA批准上市,其由瑞士Ferring Pharmaceuticals公司开发用于治疗膀胱癌,通过利用不能复制的腺病毒载体将编码干扰素α-2b的基因递送至膀胱增强机体抗肿瘤效果。另外,美国NIH等机构的一项Ⅰ期临床试验显示,利用AAV8载体向HIV感染者体内递送表达HIV-1广泛中和抗体VRC07的基因,可以使体内持久地产生具有生物活性的难以诱导产生的广泛中和抗体,并具有良好的安全性和耐受性[4]。英国伦敦大学学院的研究人员发现,在癫痫小鼠模型中,将能对神经元刺激做出反应的cfos基因的启动子和KCNA1钾离子通道基因组合后递送至体内,可有效降低过度活跃的脑细胞兴奋性,持续治疗癫痫,同时不干扰正常细胞行为,这种活性依赖性基因治疗系统为其他神经系统疾病提供了新的治疗方法[5]。比利时鲁汶大学等机构通过递送相应基因使星形胶质细胞产生IL-2,增加脑内的Treg细胞数量,在创伤性脑损伤(TBI)、中风(stroke)和多发性硬化症(MS)小鼠模型中可有效改善神经炎症[6]。
2.2 基于基因编辑技术的基因治疗研发进展
基于基因编辑技术的基因治疗可实现对特定位点的精确编辑,也称为基因编辑疗法。基因编辑技术主要包括ZFN技术、TALEN技术及CRISPR技术,其中CRISPR技术自2012年发明以来,以其简便有效迅速风靡全球,快速推动了基因编辑疗法的发展。截至2023年1月,ClinicalTrials.gov数据库收录了20项正进行或已完成的CRISPR基因编辑疗法临床试验[ii](表2),还未有上市产品。从适应证来看,基因编辑疗法目前主要用于遗传性疾病的治疗,血液遗传病是当前最为集中的研发领域。
[ii] 基于CRISPR的CAR-T疗法纳入CAR-T细胞治疗临床统计,此处不包括CAR-T细胞治疗临床数据。
表 2 正在开发的CRISPR基因编辑疗法举例
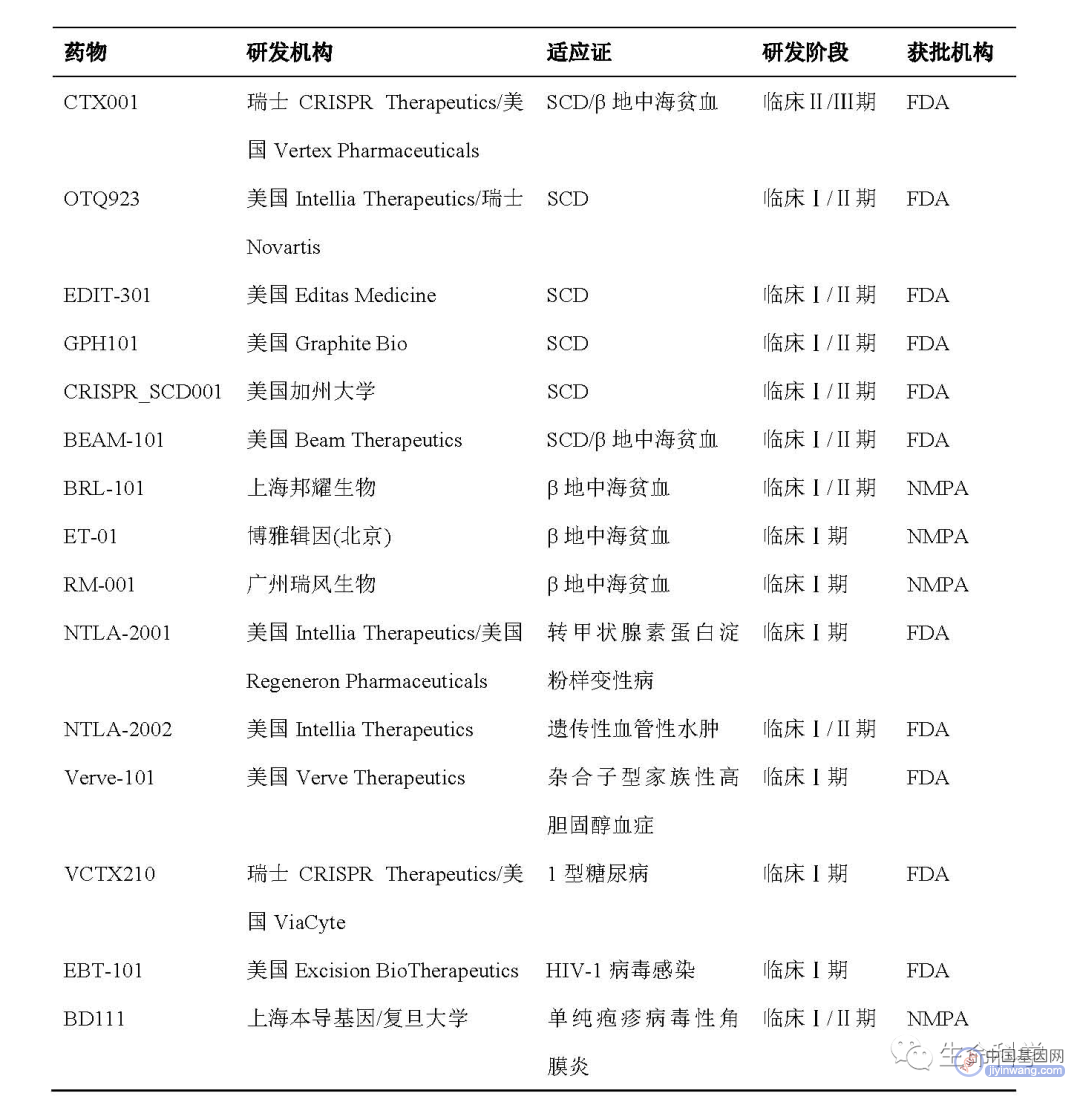
注:NMPA,国家药品监督管理局;FDA,美国食品药品监督管理局。
2.2.1 遗传性疾病基因编辑疗法研发进展
CRISPR基因编辑疗法包括体内和体外基因编辑疗法,在遗传性疾病领域均已取得多项突破性临床成果。其中,体外基因编辑疗法将迎来首个商业化产品,瑞士CRISPR Therapeutics公司和美国Vertex Pharmaceuticals公司已联合向FDA提交首个CRISPR基因编辑疗法exagagglogene autotemcel (exa-cel, CTX001)的上市申请,此前该产品治疗镰刀型细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)的临床研究取得突破性成果,并被选入Science杂志2020年十大科学突破。针对该类疾病,我国研发也取得重要进展。2022年8月,上海邦耀生物科技有限公司(邦耀生物)和中南大学利用CRISPR技术通过编辑BCL11A红系特异增强子激活γ珠蛋白的表达,回输后的自体造血干祖细胞有效缓解了β0/β0型重度地中海贫血症状,其中2名儿童患者已成功摆脱输血依赖长达2年;基于此,邦耀生物开发的基因编辑治疗药物BRL-101已获NMPA批准开展Ⅰ/Ⅱ期临床试验,并于9月份正式启动。由于基因编辑疗法在该类疾病中已展现出极大治疗潜力,全球多款基于不同靶标的产品正相继进入临床。美国Editas Medicine公司基于CRISPR/Cas12a开发的EDIT-301通过靶向γ珠蛋白基因启动子区域重新激活γ珠蛋白,进而达到治疗的目的;该产品于2021年获FDA批准开展临床,2022年先后获得FDA授予的罕见儿科疾病和孤儿药认定。我国广州瑞风生物科技有限公司也针对该靶点自主研发了β地中海贫血基因编辑药物RM-001,已获批开展临床试验。
继2020年体外基因编辑疗法临床率先取得成功后,美国Intellia Therapeutics公司等联合开发的体内基因编辑药物NTLA-2001在Ⅰ期临床试验中也取得突破性进展,中期数据显示单剂NTLA-2001可有效降低遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(ATTR-PN)患者ATTR水平,首次证明了人体体内CRISPR基因编辑的安全性和有效性,并被Science杂志选入2021年十大科学突破。2022年,该公司开发的第二款 CRISPR体内基因编辑疗法NTLA-2002也在Ⅰ期临床试验中获得积极结果,单剂NTLA-2002静脉输注可将遗传性血管性水肿(HAE)患者血浆中的关键致病蛋白水平降低92%。近一年来,研究人员在开发遗传性疾病的体内基因疗法上还取得多项临床前研究进展。香港中文大学等在成年和新生血友病B小鼠中利用低剂量AAV递送的CRISPR成功实现了有效的人源F9基因敲入和整合表达,恢复了凝血因子Ⅸ的表达,该研究为开发AAV载体介导的CRISPR疗法开发提供了支持[7]。复旦大学等机构首次利用CRISPR/Cas9技术,基于同源臂介导的末端接合(HMEJ)策略成功实现Klhl18基因的有效编辑,恢复了感受声音的内毛细胞静纤毛形态,在隐性遗传性感音神经性耳聋小鼠中显著改善听力长达6个月[8]。随着基因编辑技术的不断进步,可实现最小程度基因修饰的单碱基编辑由于更高的编辑效率和更好的安全性,在单基因遗传疾病治疗中具有巨大的潜力,目前相关产品已逐步进入临床阶段。美国Verve Therapeutics 公司开发的碱基编辑疗法 VERVE-101 在新西兰获批开展人体临床试验,用于治疗杂合子型家族性高胆固醇血症(FH),这也是首个体内碱基编辑的临床试验;临床前研究显示,在非人灵长类动物中,VERVE-101可使血液中前蛋白转化酶枯草杆菌蛋白酶 9 (PCSK9)平均降低83%,低密度脂蛋白胆固醇(LDL-C)平均减少69%[9]。
2.2.2 非遗传性疾病基因编辑疗法研发进展
除遗传性疾病外,目前体内基因编辑也正为HIV、病毒性角膜炎、乙肝及癌症等提供新治疗方法。针对HIV感染,研究人员正利用CRISPR技术开发多种体内编辑治疗策略。美国Excision BioTherapeutics公司开发的体内基因编辑疗法EBT-101,利用AAV递送的CRISPR-Cas9系统对HIV感染者体内的HIV基因组进行切除,还可最大限度地减少潜在的病毒逃逸,目前已启动Ⅰ/Ⅱ期临床试验。以色列特拉维夫大学等机构的研究人员使用AAV载体递送的CRISPR系统成功地在小鼠体内实现了B细胞编辑,并使其产生了高滴度的HIV中和抗体3BNC117[10]。上海本导基因技术有限公司开发了用于治疗病毒型角膜炎的基因编辑药物BD111,可直接靶向切割1型单纯疱疹病毒(HSV-1)基因组,于2022年6月获得FDA授予的孤儿药资格。此外,美国Beam Therapeutics公司近期的临床前数据显示其开发的多重碱基编辑平台可为乙肝治疗提供潜在方法。在癌症治疗方面,除了目前临床上主要利用CRISPR技术改造免疫细胞来实现肿瘤免疫治疗外,CRISPR基因编辑直接靶向驱动癌症的基因变异也是一个充满挑战的潜在研究方向,实现肿瘤的特异性递送以及高效率的基因编辑将有助于推动体内抗癌疗法的发展[11]。
2.3 载体递送技术研发进展
靶向递送是基因治疗的关键环节之一,对载体进行优化设计以及开发新的递送系统以实现安全有效且多种特定组织的靶向递送具有重要意义。目前的递送方式主要分两种:病毒法和非病毒法。病毒载体主要包括腺病毒、AAV、逆转录病毒、慢病毒等,具有转染效率高、宿主细胞选择范围广、基因表达稳定及持续时间长等优势,但同时具有免疫原性高、生产工艺复杂、成本较高及插入突变引起安全性问题等劣势。另外,对于CRISPR/Cas9系统来说,AAV载体容量较小,目前研究中可选择较小的Cas蛋白或采用双重AAV载体。与病毒法相比,脂质体转染法等非病毒方法生产成本较低,不易引起安全性问题,但其转染效率较低且表达持续时间短,因此在基因治疗临床试验中,以病毒为载体的递送技术仍是主流。
在众多的病毒载体中,AAV是目前基因治疗最常用的载体。不同血清型的AAV由于衣壳蛋白结构的不同,因而具有不同的组织趋向性,目前已有的十余种血清型的AAV载体可实现肝脏、肌肉及神经系统等的靶向递送,但递送效率有限,为实现相应的治疗效果需提高使用剂量,因此为避免高剂量载体带来的安全性问题,有必要进一步提高载体的靶向性及递送效率。2022年,研究人员在进一步改造病毒以有效靶向神经系统和肌肉方面取得了重要进展。美国哈佛大学等机构基于AAV9设计出一种新变体AAV.CPP.16,在小鼠和非人灵长类动物中静脉注射后可更有效地跨越血脑屏障,提高神经系统细胞的转染效率[12]。美国加州理工学院等机构也成功定向进化出新AAV9变体,不仅实现了目的基因在啮齿动物和非人灵长类动物周围神经系统中的高效递送,还可跨越血脑屏障传递至猕猴的中枢神经系统[13]。北京生命科学研究所等机构也基于AAV9定向进化得到两种新型rAAV载体AAV-cMG和AAV-MG,可在体外和体内实现小胶质细胞的有效递送[14]。德国海德堡大学等机构的研究人员开发出一种具有更高肌肉特异性的AAV载体,并在X连锁肌管肌病(XLMTM)小鼠模型中证明基于该载体开发出的基因疗法可显著改善疾病症状[15]。
除病毒载体外,其他新型载体如介于病毒载体和非病毒载体之间的类病毒体(VLP)递送技术也在不断开发中。美国哈佛大学等机构以逆转录病毒为基础开发出一种可递送碱基编辑器或Cas9核糖核蛋白的工程化病毒样颗粒eVLPs,在小鼠体内实现多个组织的高效基因编辑治疗,包括降低血清中PCSK9蛋白浓度及部分恢复遗传性失明小鼠的视觉功能[16]。
3 未来展望与趋势
近十年来,基因治疗在遗传性疾病领域取得了多项突破,未来扩大疾病治疗范围、实现更多组织器官的靶向递送、进一步提升长期有效性和安全性以及提高可及性等将成为基因治疗的发展重点。
从研究角度来看,在大数据时代,充分利用人类基因组测序成果,加强对疾病的基础性研究,开发更多的新靶点、新机制和新治疗方法,将极大突破当前遗传性疾病的治疗范围。作为基因治疗过程中的关键技术,递送技术的进步将极大推动基因治疗应用范围,高效、安全、低免疫原性的新型基因治疗载体仍需不断优化、开发。通过对AAV进行各种定向进化和合理设计改造,以进一步实现除肝外向其他组织器官,如中枢神经系统、肺、肌肉等的安全有效递送,也将极大地扩展未来基因治疗的适应范围,为更多疾病带来有效治疗手段,而开发更多有效的非病毒载体,如脂质纳米颗粒、类病毒体以及细胞外囊泡等,还将有助于进一步降低生产成本。
此外,基因治疗领域还要关注治疗的持久性和安全性问题以及卫生经济学问题。目前,基因治疗的持久性仍需长期随访证明。在安全性方面,人类目前对疾病基因的功能以及相关生物学机制的了解有限,使基因治疗仍面临一定风险,AAV、Cas蛋白的免疫原性及患者体内预存Cas蛋白抗体等也为基因治疗的临床应用带来挑战。加强对疾病的生物学理解将提升基因治疗的安全性,同时,提升编辑效率也将减小由于基因编辑技术的脱靶效应带来的未知安全问题。整体来看,为保证基因治疗的安全性和有效性,尚需长期、全面、深入的临床前和临床研究。在卫生经济学方面,基因治疗药物牢牢占据全球最贵药物榜单,如儿童脊髓性肌萎缩基因治疗药物Zolgensma定价212.5万美元,β地中海贫血基因治疗药物Zynteglo定价280万美元,血友病B基因治疗药物Hemgenix定价350万美元,高昂定价已成为限制其使用的一大重要因素,多款药物如Zynteglo在欧洲面临商业化失败问题。未来或可通过关键技术创新、生产技术优化等进一步降低生产成本,探索新的支付条件及医保条件,如分期付款、按疗效付费等方式来解决。
[参 考 文 献]
[1] Flotte TR, Cataltepe O, Puri A, et al. AAV gene therapy for Tay-Sachs disease. Nat Med, 2022, 28: 251-9
[2] Xue F, Li H, Wu X, et al. Safety and activity of an engineered, liver-tropic adeno-associated virus vector expressing a hyperactive Padua factor IX administered with prophylactic glucocorticoids in patients with haemophilia B: a single-centre, single-arm, phase 1, pilot trial. Lancet Haematol, 2022, 9: e504-13
[3] Xue F, Wang P, Yuan Z, et al. Total knee arthroplasty after gene therapy for hemophilia B. N Engl J Med, 2022, 387: 1622-4
[4] Casazza JP, Cale EM, Narpala S, et al. Safety and tolerability of AAV8 delivery of a broadly neutralizing antibody in adults living with HIV: a phase 1, dose-escalation trial. Nat Med, 2022, 28: 1022-30
[5] Qiu Y, O'Neill N, Maffei B, et al. On-demand cell-autonomous gene therapy for brain circuit disorders. Science, 2022, 378: 523-32
[6] Yshii L, Pasciuto E, Bielefeld P, et al. Astrocyte-targeted gene delivery of interleukin 2 specifically increases brain-resident regulatory T cell numbers and protects against pathological neuroinflammation. Nat Immunol, 2022, 23: 878-91
[7] He X, Zhang Z, Xue J, et al. Low-dose AAV-CRISPR-mediated liver-specific knock-in restored hemostasis in neonatal hemophilia B mice with subtle antibody response. Nat Commun, 2022, 13: 72-5
[8] Gu X, Hu X, Wang D, et al. Treatment of autosomal recessive hearing loss via in vivo CRISPR/Cas9-mediated optimized homology-directed repair in mice. Cell Res, 2022, 32: 699-702
[9] Lee RG, Mazzola AM, Braun MC, et al. Efficacy and safety of an investigational single-course CRISPR base editing therapy targeting PCSK9 in non-human primate and mouse models. Circulation, 2023, 147: 242-53
[10] Nahmad AD, Lazzarotto CR, Zelikson N, et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nat Biotechnol, 2022, 40: 1241-9
[11] Katti A, Diaz BJ, Caragine CM, et al. CRISPR in cancer biology and therapy. Nat Rev Cancer, 2022, 22: 259-79
[12] Yao Y, Wang J, Liu Y, et al. Variants of the adeno-associated virus serotype 9 with enhanced penetration of the blood-brain barrier in rodents and primates. Nat Biomed Eng, 2022, 6: 1257-71
[13] Chen X, Ravindra Kumar S, Adams CD, et al. Engineered AAVs for non-invasive gene delivery to rodent and non-human primate nervous systems. Neuron, 2022, 110: 2242-57.e6
[14] Lin R, Zhou Y, Yan T, et al. Directed evolution of adeno-associated virus for efficient gene delivery to microglia. Nat Methods, 2022, 19: 976-85
[15] El Andari J, Renaud-Gabardos E, Tulalamba W, et al. Semirational bioengineering of AAV vectors with increased potency and specificity for systemic gene therapy of muscle disorders. Sci Adv, 2022, 8: eabn4704
[16] Banskota S, Raguram A, Suh S, et al. Engineered virus-like particles for efficient in vivo delivery of therapeutic proteins. Cell, 2022, 185: 250-65.e16
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。