存在多个甲状腺结节,有必要对每个结节分别做NGS基因检测吗?
很多甲状腺乳头状癌(PTC)表现为多病灶,但病灶间的克隆关系仍不明确。PTC多个同时存在的肿瘤病灶可能由单个恶性克隆腺内淋巴管扩散造成,也可能来源于不同遗传事件导致的多个独立祖细胞克隆。本文报道了一例37岁男性患者,接受了双侧甲状腺结节细针穿刺抽吸活检,细胞学结果符合意义未明的非典型细胞/意义未明的滤泡性病变。甲状腺癌相关基因NGS检测显示较大的肿瘤携带NRAS基因突变,而对侧肿瘤携带HRAS基因突变。进行了甲状腺全切术,手术样本最终病理诊断为16mm右叶和6mm左叶包裹性滤泡亚型乳头状癌。据我们所知,这是第四例携带HRAS和NRAS突变的多灶性PTC病例报道,强调除了BRAF和RET基因突变,其他基因突变状态也存在异质性,支持甲状腺乳头状癌多灶性可能由多个独立祖细胞克隆导致的假设。
背景
甲状腺乳头状癌(PTC)约占所有甲状腺恶性肿瘤的80%-90%。PTC通常表现为两个或以上解剖学上独立的病灶,多病灶发生率在18%-87%之间,大多数在手术病理样本检查时发现镜下播散。双侧病灶——多病灶的一种类型——可见于13%–56%的甲状腺手术切除样本。
多病灶可能来源于同一个克隆,由恶性细胞克隆群甲状腺内扩散导致。也可能由区域癌变下单独出现的独立克隆发展而来,导致高度的遗传异质性。区分这两种多灶性机制对于治疗决策和预后可能很重要:如果多灶性PTC是由甲状腺内转移引起的,进一步转移和复发的风险可能较高。
大多数多灶性PTC克隆起源相关研究分析了BRAF和RET/PTC突变,关于RAS突变的数据很少。本文报道了一例携带两种不同RAS突变的双侧滤泡亚型PTC罕见病例。
★病例★
一例37岁男性来我中心进行甲状腺结节检查。该男性甲状腺功能正常,否认有局部压迫症状。体格检查正常。父亲罹患胃癌和PTC,除此以外,没有其他甲状腺癌危险因素。抗甲状腺抗体呈阴性。
五个月前,在另一中心进行的甲状腺超声检查显示有两个甲状腺结节,大小为14 mm(右叶)和10 mm(左叶)。右侧甲状腺结节细胞学诊断为意义未明的非典型细胞/意义未明的滤泡性病变(AUS/FLUS)(Bethesda III类),左侧结节细胞学样本不满意(Bethesta I类)。
六个月后,在我中心进行重复细针穿刺抽吸活检(FNAs)。细胞学检查显示两个结节均为AUS/FLUS,最大前后径、横径和纵径分别为10.6 × 11.4 × 16.5 mm(右叶结节)和5.4 × 10.2 × 10.1 mm(左叶结节)。两个结节超声检查均无可疑恶性特征(图1)。三个月后进行的第三次FNA显示右叶结节为滤泡性肿瘤/可疑滤泡性肿瘤(Bethesda IV类),左叶结节为AUS/FLUS(Bethesta III类)(图2)。
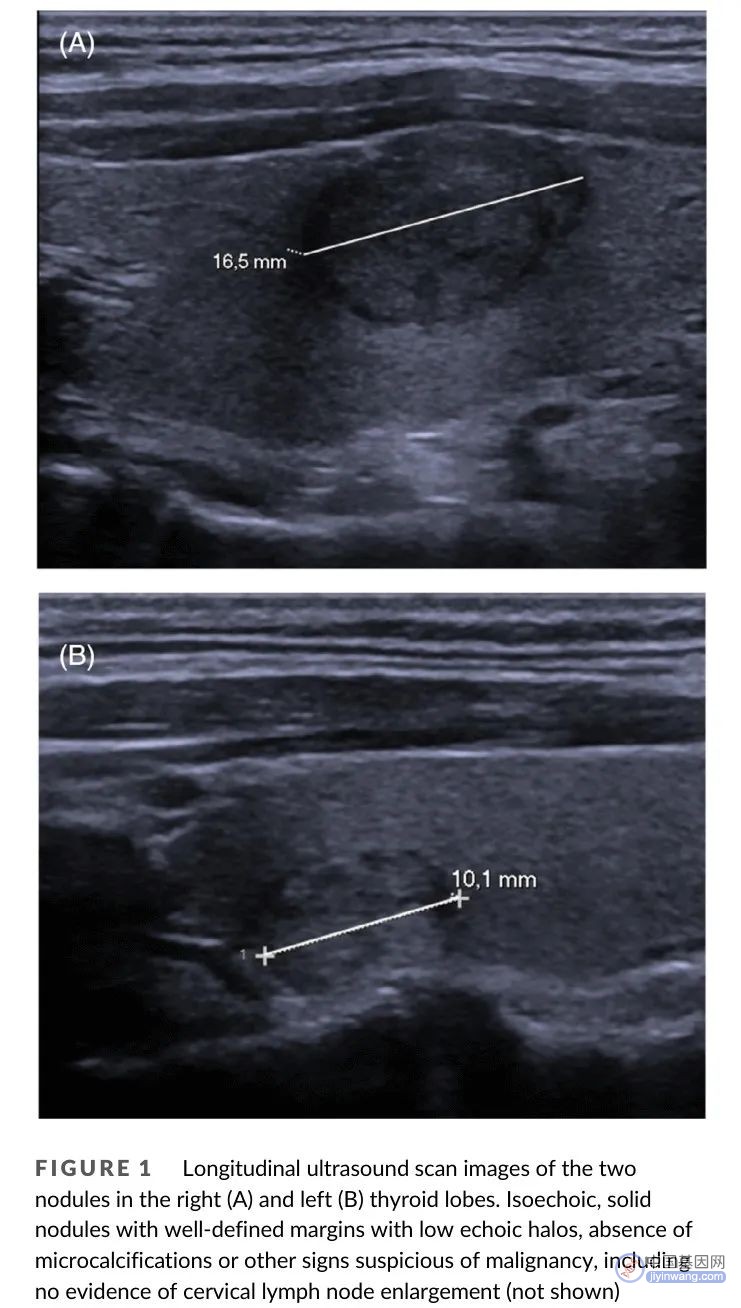
图1. (A) 右叶和 (B) 左叶结节纵向超声扫描图像。等回声实性结节,边缘清晰,有低回声晕,无微钙化或其他可疑恶性特征,包括无颈部淋巴结肿大
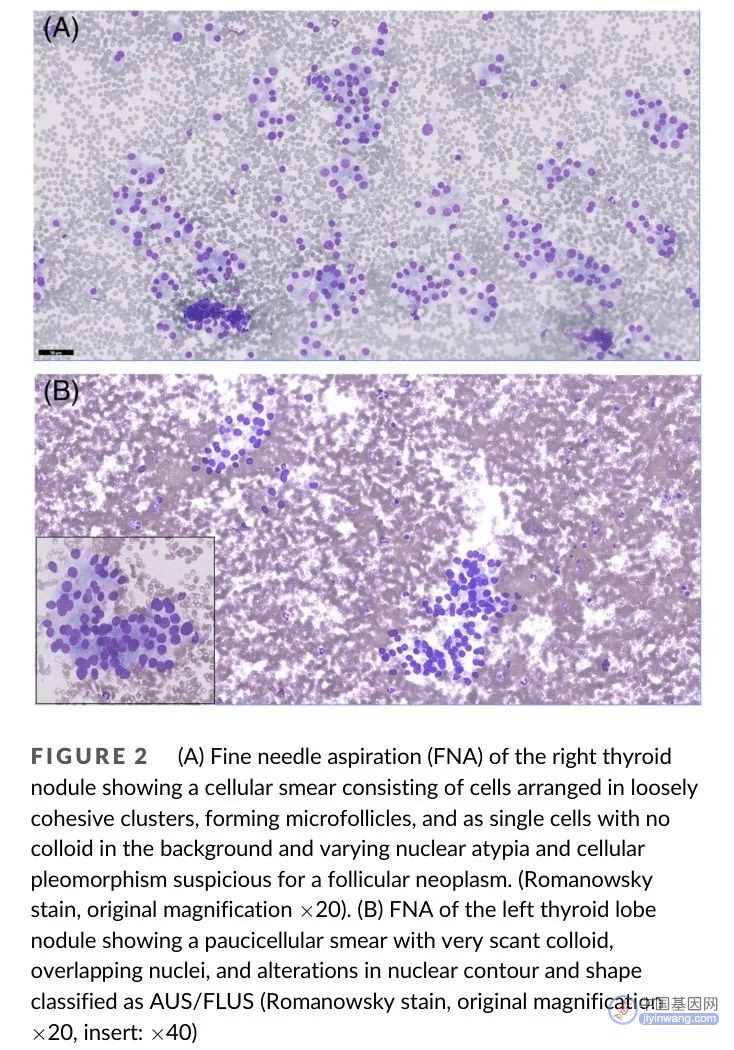
图2. (A) 右叶结节FNA考虑为滤泡性肿瘤;(B) 左叶结节FNA考虑为AUS/FLUS
从两个FNA样本中提取DNA进行NGS检测,包括RET重排以及7个高频突变基因(BRAF、HRAS、KRAS、NRAS、PIK3CA、RET和TERT启动子)体细胞突变检测。16mm的右侧甲状腺结节检出NRAS NM_002524.4:c.182A > G p.(Gln61Arg) 突变,为I级突变,具有临床意义,突变丰度(VAF)为40%。10mm的左侧甲状腺结节检出HRAS NM_005343.2:c.182A > G p.(Gln61Arg) (Q61R) 突变,VAF为38%,为II级突变,具有潜在临床意义。
患者接受了甲状腺全切术,未进行淋巴结清扫术。右侧和左侧结节的最大径分别为16mm和6mm。手术标本最终病理学显示两个结节均为包裹性滤泡亚型乳头状癌,存在包膜侵犯,表现出难以区分的组织病理学特征(图3)。未发现神经或淋巴血管浸润,未发现淋巴细胞浸润或甲状腺外扩散。
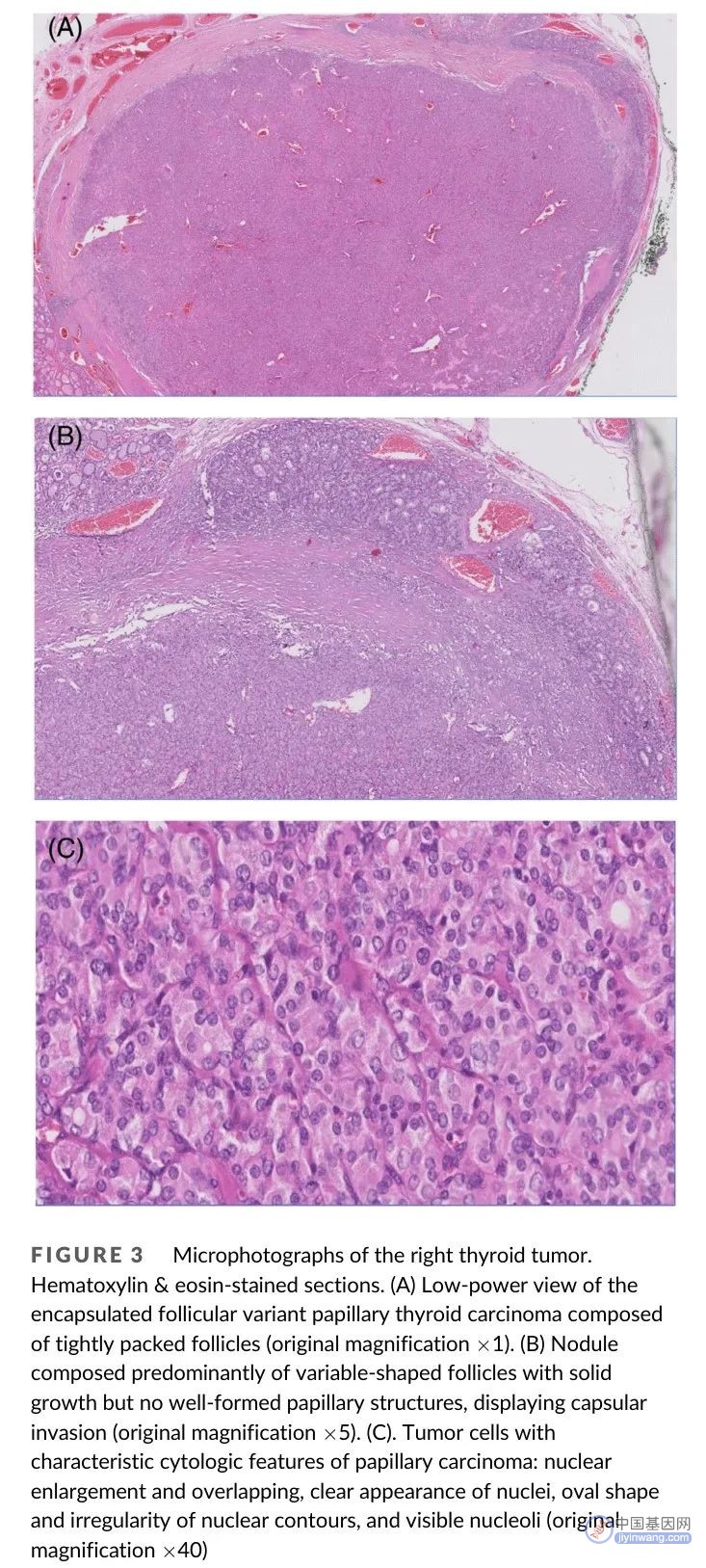
图3. 右侧甲状腺肿瘤显微图像,苏木精和伊红染色切片
患者接受了I-131放射性碘治疗,消融剂量102 mCi。未发现局部或远处转移。
讨论
PTCs可表现为甲状腺多个独立病灶。通常不确定PTC多个同时存在的肿瘤病灶是来源于多个独立的祖细胞克隆,还是单个恶性克隆腺内扩散导致。为了确定多灶性PTC的克隆起源,几种技术得到了应用,包括X染色体失活、杂合性缺失,以及最近点突变或RET/PTC重排检测,主要使用石蜡包埋显微解剖组织。
由于在PTC中,BRAF V600E突变约占60%,大多数多灶性PTC克隆起源相关研究关注该基因变异。基于BRAF点突变分析,约40%的多灶性PTC起源于多个独立克隆。进行NGS基因检测,该比例更高。Lu等人的研究显示,进行NGS检测(包括BRAF突变)的多灶性PTC患者中,75%为多克隆起源。在多灶性PTC中,关于BRAF突变状态差异,大多数在于不同病灶是否检出BRAF突变,而非BRAF不同位点突变,但存在同一患者不同病灶分别检出BRAF和其他基因(RAS较常见)突变的情况。
在多灶性PTC中,基于RET/PTC基因重排,Sugg等人报道了不同重排发生率较高,15/17例患者多个肿瘤有多个不同的RET/PTC转录本,提示为不同起源的独立肿瘤。
在甲状腺癌中,RAS相关激活点突变是第二常见的基因突变,仅次于BRAF突变。这些突变主要与滤泡性甲状腺肿瘤相关。20%-25%的滤泡性腺瘤、30%-45%的滤泡亚型PTC和滤泡癌、20%-40%的低分化癌和20%-30%的间变性癌存在RAS突变。具有乳头状核特征的非浸润性滤泡性甲状腺癌也可能存在RAS突变,尽管发生率低于滤泡亚型PTC。
在60例多灶性PTC患者中,33/124个独立病灶检出RAS突变。6例(10%)有两个肿瘤病灶的患者检出不同类型的RAS突变:3例患者与本文患者一样,一个肿瘤携带HRAS突变,另一个肿瘤携带NRAS突变,而另外3例患者两个肿瘤均携带NRAS突变,但密码子61核苷酸变异类型不同。据我们所知,本病例是第四例多灶性PTC患者检出不同RAS突变的病例。两个肿瘤均符合浸润性包裹性滤泡亚型PTC,其分子特征与滤泡性腺瘤和癌相似(RAS突变发生率高,BRAF突变阴性)。相比之下,浸润性滤泡亚型PTC具有不同的分子特征,与典型PTC相似(BRAF突变 > RAS突变)。本文患者检出的突变是包裹性滤泡亚型PTC中最常见的RAS突变。
多灶性PTC的克隆起源可能与预后相关。与多个独立克隆起源的多灶性PTC相比,单个恶性克隆甲状腺内转移引起的多灶性PTC甲状腺外扩散、淋巴结转移和疾病复发的风险显著增加,需要更积极的治疗。考虑到本文患者病灶总共22 mm、父亲罹患甲状腺癌、术后刺激性甲状腺球蛋白浓度(>1.0ng/mL),甲状腺全切术后进行了放射性碘消融治疗。
总之,本文描述了一例滤泡亚型PTC患者双侧病灶分别检出HRAS和NRAS突变。这一发现符合独立多克隆起源,支持先前BRAF突变和RET/PTC重排相关研究。
参考文献:
Marín F, Del Nuevo E, Belinchón A, Acevedo A. Bilateral follicular variant of papillary thyroid cancer with different RAS mutations detected with next-generation sequencing: Report of an unusual case and literature review. Diagn Cytopathol. 2022 Oct;50(10):E275-E279. doi: 10.1002/dc.25004. Epub 2022 Jun 18. PMID: 35716104; PMCID: PMC9545367.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。