前沿:治愈HIV感染新策略!双重CRISPR基因编辑完全清除病毒

近日发表在美国《国家科学院院刊》(PNAS)上的一项研究中,科学家使用CRISPR基因编辑技术,与长效抗逆转录病毒疗法(ART)相结合,在小鼠HIV感染模型中在约60%的动物中完全清除了HIV病毒。研究人员表示,这一研究结果展现了CRISPR基因编辑技术在治愈HIV感染方面的潜力。

虽然目前的ART疗法使HIV感染者在确诊后的寿命与未感染HIV的个体几乎相同,但是它们并不能完全清除病毒。因此患者必须在余生中每天服用药物以保持病毒抑制。这可能导致耐药性和其他并发症。HIV病毒的DNA在感染后不久就会整合到宿主基因组中,现有ART无法清除整合到基因组的HIV病毒DNA。这也是患者一旦停药,HIV病毒水平反弹的原因。
在这项新研究中,研究团队首先让HIV阳性小鼠服用长效缓释ART疗法,一个月之后,他们利用CRISPR-Cas9基因编辑技术,对表达CCR5受体的基因进行编辑,降低CCR5受体的表达水平。CCR5是HIV病毒进入T细胞的途径,目前知道的几例被治愈的HIV感染者都接受过CCR5缺失的干细胞移植。
在CCR5水平降低到最低后,研究人员进行了第二次基因编辑,这次CRISPR-Cas9系统用于从宿主基因组中去除整合的HIV病毒DNA。科学家们停止了ART治疗,并且在两个月后检查HIV病毒水平是否会反弹。在小鼠模型中,HIV反弹通常在治疗后两周内发生。
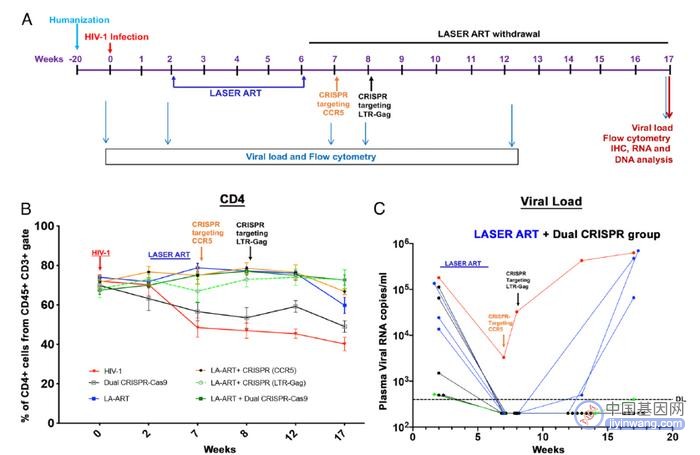
▲实验流程,CRISPR基因编辑对CD4阳性T细胞水平和HIV病毒水平的影响(图片来源:参考资料[2])
研究人员使用了多种高度敏感的技术,以确保他们没有错过一个病毒基因拷贝,他们不仅检查了动物的血液,还检查了病毒已知能渗透的所有器官系统。在治疗组的10只动物中,他们在6只动物中找不到病毒的踪迹。重复研究得出了类似的结果:在第二轮实验中,9只接受治疗的小鼠中有5只完全无病毒。
“我们的下一个目标是提高这种方法和CRISPR在消除病毒和防止病毒传播方面的效力。”这篇论文的通讯作者之一,天普大学(Temple University)医学院的Kamel Khalili博士说。他补充说组合基因编辑疗法可能是达到这一目标的途径。研究人员特别感兴趣的是开发可以实现多次输送基因疗法的递送系统,包括具有高度靶向性的纳米颗粒以及工程化改造的高效且无害的病毒载体,最终目标是将疗法应用于临床。
参考资料:
[1] Dual CRISPR therapy plus long-acting ART eliminates HIV in mice. Retrieved May 2, 2023, from https://www.fiercebiotech.com/research/dual-crispr-therapy-plus-long-acting-art-eliminates-hiv-mice
[2] Dash et al., (2023). CRISPR editing of CCR5 and HIV-1 facilitates viral elimination in antiretroviral drug-suppressed virus-infected humanized mice. PNAS, https://doi.org/10.1073/pnas.2217887120
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。