全球首个LNP递送的体内基因编辑疗法获批临床
3月2日,宣布FDA批准其NTLA-2002的研究性新药(IND)申请,NTLA-2002是一种体内基因编辑药物,旨在使靶基因激肽释放酶B1(KLKB1)失活,在单剂治疗后永久性降低血浆激肽释放酶蛋白活性,从而阻止遗传性血管性水肿(HAE)发作。NTLA-2002是首个被FDA批准用于人体试验的、由脂质纳米颗粒(LNP)递送的体内基因编辑疗法。

Intellia总部位于美国马萨诸塞州,专注于利用基于CRISPR/Cas9技术开发潜在的治疗性疗法。公司的体内项目使用静脉给药的CRISPR作为治疗,其专有的递送技术可以在特定的靶组织内直接对致病基因进行高度精确地编辑。
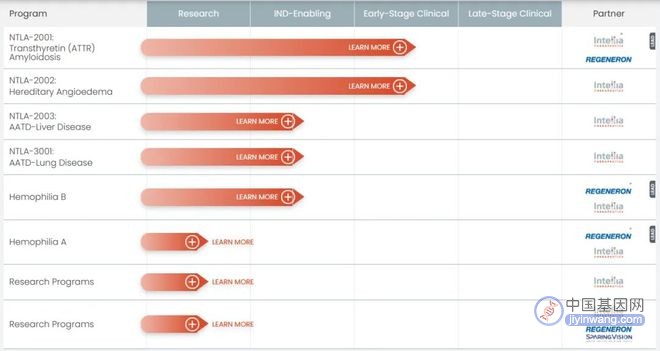
Intellia体内项目管线(来源:官网)
其离体项目使用CRISPR技术,通过工程人类细胞来治疗癌症和自身免疫疾病。

Intellia离体项目管线(来源:官网)
NTLA-2002是Intellia的第二款CRISPR治疗候选药物,通过静脉输注的方式进行系统给药,单次给药即可编辑人体内的致病基因。Intellia的I/II期研究正在评估NTLA-2002用于I型或II型HAE成人患者的安全性、耐受性、药代动力学和药效学。
Intellia总裁兼首席执行官John Leonard博士说:“FDA接受我们的IND申请,使我们离为遗传性血管性水肿患者引入潜在的范式治疗又近了一步。NTLA-2002 IND的批准对Intellia来说是一个重要的里程碑,我们正在努力快速招募II期临床患者,期待在今年晚些时候提供I期临床试验的数据。”
参考资料:
https://ir.intelliatx.com/news-releases/news-release-details/intellia-therapeutics-announces-fda-clearance-investigational
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。