Nature:是时候把基因疗法数百万美元的价格打下来了!
1953年,DNA双螺旋结构首次报道时,James Watson和Francis Crick在文章中写到“这种结构非常新颖,生物学意义巨大。”70年里,科研人员前赴后继地探索DNA的医学意义,并开创了一系列新型疗法。
70年后,世界也可能把2023年视为一个里程碑。据了解,今年首个基于CRISPR–Cas9基因编辑的疗法可能获批,这种疗法通过纠正体细胞中的DNA达到治疗作用。目前,美国、欧盟和英国的监管机构正在评估基于这种方法治疗镰状细胞病的创新疗法,未来几个月内就会公布最终结果。
尽管基因疗法已经取得了长足的进展,研发人员还是对基因编辑和其他基因疗法的医疗前景表示担忧。基因疗法的价格令人咋舌,真正需要这种技术的患者难以从中获益。因此,卫生经济学家必须与行业、政府一道,找到真正切实可行的支付方式。
一针就要上百万美元天价药,谁能用?
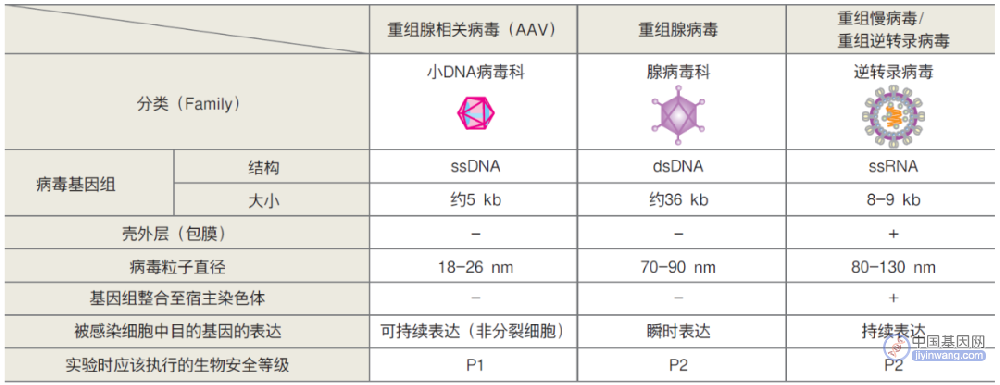
CRISPR–Cas9基因编辑疗法能够快速进入临床,建立在过去多年通过病毒载体将基因递送到靶细胞中进行基因编辑的基础上。过去十年里,全球监管机构已经批准了包括CAR-T细胞在内的基因疗法,这种创新技术通过操作免疫细胞来对抗肿瘤,而更多的技术正处于临床试验阶段。
这些疗法单次治疗的费用就高达100万美元,如果考虑住院费等其他花费,价格只会更贵。去年,FDA批准了首款治疗B 型血友病的基因疗法单次治疗的费用高达350万美元,使其成为有史以来世界上最昂贵的药物。
和小分子药物等更加成熟的疗法相比,基因疗法的开发和生产成本更高,但也正是这种技术可以为患者真正带来治愈的希望,让病人摆脱长期以来服用药物的风险。因此,有些人认为如果一种技术可以节省后续可能高达上百万美元的支出,那么在开始治疗时花费几百万美元还是合理的。
在相对发达的国家里,医疗保健系统也难以承受与基因疗法相关的巨额药费。2021年,因Bluebird Bio未能与欧洲当局就β-地中海贫血基因疗法药物价格达成协议,Bluebird 撤销了在欧洲销售这种产品的计划,而是将销售重点放在美国。美国医疗保险通过由雇主提供补贴,而一些雇主已经表示明年会限制基因疗法的覆盖范围。
基因疗法在中低收入国家完全陷入困境。基因疗法的某些适应症(如β-地中海贫血和镰状细胞病)在贫困地区更加常见。例如,在撒哈拉以南的某些地区,约2%的新生儿被确诊为镰状细胞病,由于筛查比例很小,公布的患儿比重可能偏小。
提高可及性
今年3月在伦敦召开的第三届人类基因组编辑国际峰会上,与会人员的关注重点集中在如何通过简化此类疗法的生产测试工艺降低价格,从而提高基因编辑疗法的可及性,尤其是对于中低收入国家。例如,目前治疗镰状细胞病的产品需要临床医生分离造血干细胞并进行编辑处理,并将处理过的细胞重新回输到患者体内。如果能够实现对靶细胞的在体编辑就可以大大降低基因疗法的价格,从而提高这种技术的可及性。
另一种思路是开发安全有效的基因治疗平台,基因疗法的开发人员只需对疾病的靶基因进行替换,无需进行额外的安全性和有效性测试。
降低基因疗法药价的可选策略并不多。一些学术中心正在尝试不依赖制药公司开发基因疗法产品,但是没有产业界的资金支持和药政知识,这些努力会取得多大成果尚未可知。
除了产品定价之外,基因疗法还陷入了监管和知识产权的纠纷。基因疗法将释放多大的能量,直接取决于科研人员能够多大程度上利用James Watson和Francis Crick的发现。因此,科学家经过深入讨论后,应该及早公布行业共识,从而促进基因疗法的健康发展。
参考资料:
[1]The gene-therapy revolution risks stalling if we don’t talk about drug pricing. Nature. 2023.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。