基因治疗技术:肿瘤治疗的一种新希望
肿瘤,作为危害人类健康的重大疾病,是许许多多个体与家庭的苦痛之源。它的发生发展过程极其复杂,由多因素(包括外部环境因素及个体内部因素)引起,涉及多基因的互作。和正常细胞相比,肿瘤细胞的形态、生长规律及其代谢都有所不同。由于肿瘤细胞的转移、复发、异质性以及对化疗和放疗的耐药性,目前除了早期实施肿瘤切除、化放疗外,并没有更多的有效治疗手段。
在不断寻求新手段的过程中,基因治疗已经让人们看到了一些曙光。
基因治疗是指通过载体将外源性目的基因引入相应的靶细胞,以纠正过度活化或补偿缺陷的基因,从而达到疾病治疗的目的。具体到肿瘤基因治疗,则是通过相应载体将目的基因导入相应的靶细胞(如:免疫细胞或肿瘤细胞)最终达到肿瘤治疗之目的。目前,被证实行之有效的肿瘤基因治疗是基于免疫细胞疗法的CAR-T治疗(chimeric antigen receptor T cell therapy, CAR-T)及基于溶瘤病毒(oncolytic virus,OVs)的肿瘤基因治疗。
01
CAR-T细胞疗法
CAR-T细胞疗法的主要步骤是这样的:
(1)在体外构建嵌合抗原受体(chimeric antigen receptor, CAR);
(2)通过相应的载体将CAR导入来源于病人的T细胞中从而获得CAR-T细胞;
(3)在体外将CAR-T细胞进行培养及扩增后再输送回患者体内,使其特异性攻击肿瘤,从而达到治疗目的(图1)。
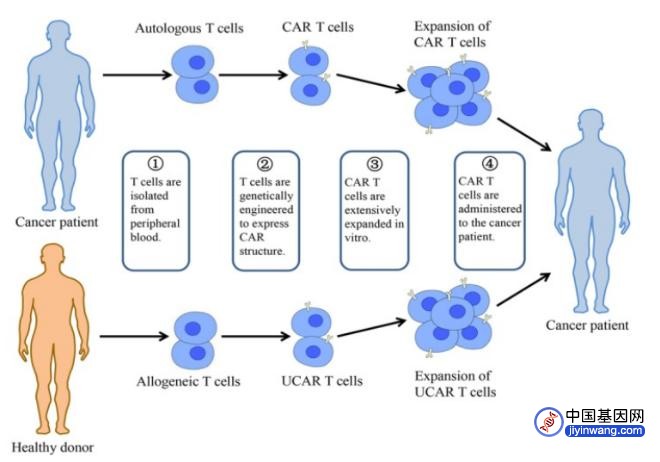
图1 CAR-T治疗示意图
图注:从患者外周血中分离出患者自体T细胞或来自健康供体的T细胞后,经过基因工程技术将CAR基因导入T细胞中,产生CAR-T或UCAR-T,在体外经过扩增培养再输入患者体内,使其在体内发挥抗肿瘤的作用。
其中,CAR的基本结构包括识别肿瘤相关抗原(TAA)的胞外结构域、细胞外铰链区、跨膜区和与CAR-T活化相关的胞浆结构域(图2)。
CAR-T细胞在肿瘤治疗中有着自己独到的优势: 首先是靶向性强。CAR-T细胞能通过胞外单链抗体特异性识别肿瘤抗原并激活细胞内共刺激信号域,进而刺激T细胞(T淋巴细胞)增殖;其次是识别抗原范围广。CARs几乎可以识别所有抗体能识别的抗原,包括蛋白质抗原、碳水化合物抗原和脂类抗原等,大大扩展了肿瘤抗原的靶点范围;而且它抗肿瘤效果更持久——将共刺激分子或者激活信号整合到CAR中,使CAR-T细胞在抗肿瘤的同时还能提高自身的增殖能力,增加其在体内存活时间,部分细胞甚至能以记忆细胞的形式存在,这样就大大延长了杀伤肿瘤细胞时间。
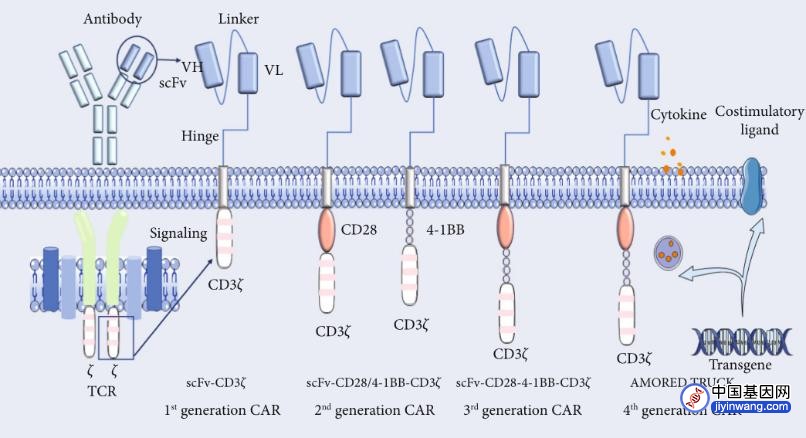
图2 CAR-T结构示意图
图注:CARs共划分为4代:第一代CARs由scFv抗原识别域和CD3ζ胞内信号域组成;第二代CARs在已经存在的scFv和CD3 ζ链上增加了细胞内共刺激域CD28或4-1BB;第三代CARs结合了两个共刺激域,如4-1BB和CD28与CD3ζ域;第四代CARs在第二代CARs的基础上增加了共刺激转基因或细胞因子。
CAR-T细胞免疫疗法已经在治疗B细胞恶性肿瘤方面取得了令人瞩目的结果。到目前为止,全球已批准6款CAR-T细胞疗法上市,其中美国食品和药品管理局(FDA)批准了5款,这五种CAR-T细胞疗法被批准用于治疗复发或难治性血液恶性肿瘤:淋巴瘤、B细胞源性白血病和多发性骨髓瘤。
除了在血液肿瘤中的应用,CAR-T细胞在实体瘤治疗中的研究更是如火如荼。不过,目前的临床疗效仍不尽如人意,因此人们仍然需要寻找新的效应细胞作为CAR修饰的候选细胞进行研究。近年来,研究的重点已从T细胞转向具有更高安全性及更强细胞毒性的NK细胞。
02
基于溶瘤病毒的肿瘤基因治疗
溶瘤病毒(oncolytic virus, OVs),是一类天然的或经基因改造的、能够特异性在肿瘤细胞中复制并造成细胞裂解死亡的病毒,而该溶瘤病毒对其他正常组织细胞几乎没有毒性作用。
利用溶瘤病毒的特性,我们可以通过多种途径来发挥它的抗肿瘤作用(图3):
(1)直接溶瘤。溶瘤病毒成功靶向并感染肿瘤细胞后,病毒以细胞作为加工厂并在其中大量复制,最终裂解肿瘤细胞;
(2)诱导固有免疫应答杀伤肿瘤。溶瘤病毒可以促进免疫原性细胞死亡,从而释放损伤相关分子模式,随后吸引先天免疫细胞到肿瘤中,并介导肿瘤特异性T细胞在肿瘤微环境中的募集和成熟;
(3)诱导适应性免疫应答杀伤肿瘤。局部的溶瘤病毒治疗,可以通过裂解癌细胞释放出大量肿瘤相关抗原,促进肿瘤抗原的提呈与识别,便于抗原呈递细胞实现它们的功能及启动T细胞免疫应答;
(4)改变肿瘤微环境。溶瘤病毒能够全身递送免疫检查点抑制剂、治疗基因、共刺激分子基因、趋化因子等改变肿瘤免疫抑制的微环境,实现肿瘤溶瘤病毒基因治疗。因此,溶瘤病毒也是肿瘤免疫与基因治疗的重要组成部分。
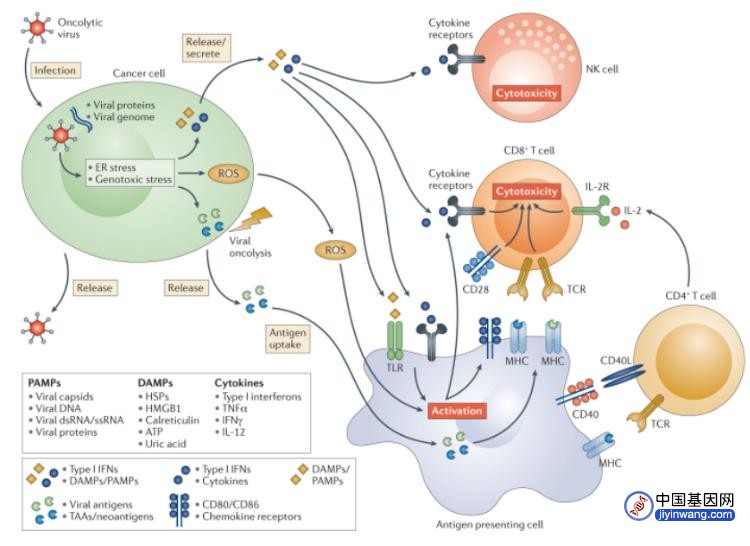
图3 溶瘤病毒作用机制
图注:溶瘤病毒感染肿瘤细胞后导致细胞死亡并释放肿瘤相关抗原以及各种促免疫原性因子,如病原相关分子模式、损伤相关分子模式和细胞因子(例如IFN-α,IFN-γ,TNF-α,IL-6和IL-1)等;随后吸引先天免疫细胞到肿瘤中,便于抗原呈递细胞实现它们的功能及启动T细胞免疫应答。
目前,来源于基因工程单纯性疱疹病毒的溶瘤病毒(Talimogene Laherparepvec,T-VEC)已经获得美国食品和药品管理局(FDA)的上市批准,这也是溶瘤病毒在癌症治疗领域中的一个重大飞跃。此外,包括痘苗病毒(vaccinia virus,VV)、柯萨奇病毒(coxsackie virus,CV)、腺病毒(adenovirus)、呼肠孤病毒(reovious)、单纯疱疹病毒(herpes simplex virus)和麻疹病毒(Measles virus, MV)等在内的几种病毒正在被广泛研究,许多溶瘤病毒产品进入到了临床试验阶段,个别产品已进入到临床III期。
随着肿瘤免疫治疗方法的进步,人们发现,OVs和免疫治疗的组合治疗非常具有吸引力。研究人员已经尝试将溶瘤病毒治疗与其他抗肿瘤治疗结合,包括放疗、化疗、免疫检查点抑制剂(immune checkpoint inhibitor, ICI)、CAR-T细胞治疗以及双特异性T细胞结合物(BiTE),这些与OVs的联合治疗能够有效地进一步提高抗肿瘤效果。
结语
近年,世界上首个基因治疗产品已率先上市用于恶性肿瘤的治疗。相信随着生物技术的发展以及抗血管生成基因治疗、免疫基因治疗、自杀基因治疗、siRNA治疗、抑癌基因治疗和促凋亡基因治疗等各种基因治疗策略不断被开发并运用于癌症治疗,未来,肿瘤患者将有望迎来“有药可救”的新时代。
参考文献:
【1】 Yonggui Tian,Yilu Li,Yupei Shao,Yi Zhang. Gene modification strategies for next-generation CAR T cells against solid cancers. J Hematol Oncol. 2020,13(1):54.
【2】 Zhang Q, Ping J, Huang Z, Zhang X, Zhou J, Wang G, Liu S, Ma J. CAR-T Cell Therapy in Cancer: Tribulations and Road Ahead. J Immunol Res. 2020, 2020:1924379.
【3】 Kaufman HL, Kohlhapp FJ, Zloza A. Oncolytic viruses: a new class of immunotherapy drugs. Nat Rev Drug Discov. 2015 ,14(9):642-62.
作者简介:
陈园坤 陕西师范大学生命科学学院基因治疗研究室
夏海滨 陕西师范大学生命科学学院基因治疗研究室
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。