首个以基因组为特征的食管癌分型建立,精准免疫治疗再进一步
免疫联合化疗已经成为晚期食管鳞癌(ESCC)一线标准治疗。然而并非所有患者均具有一致良好反应,如何进行获益人群选择成为当前研究热点。
中山大学肿瘤防治中心徐瑞华教授、王峰教授团队对 JUPITER-06 研究中 ESCC 患者样本行基因检测,建立了免疫联合化疗获益相关基因组免疫-癌基因特征为基础的新分型,结果发表在 Cancer Cell 上。

免疫治疗开启了晚期 ESCC 的治疗新纪元,PD-1 抑制剂联合化疗可显著改善初治晚期 ESCC 患者预后,成为治疗新标准。但是并非所有患者反应一致,生存改善也仅为 3 个月左右,亟需可以指导患者选择的疗效预测生物标志物。
JUPITER-06 是一项在晚期 ESCC 患者中进行的随机 Ⅲ 期研究,结果显示特瑞普利单抗联合化疗可显著改善患者预后。同时研究还进行了前瞻性生物标志物探索,使用全外显子测序(WES)发现免疫联合化疗的疗效预测免疫原性和癌基因特征,构建食管癌基因组为基础的免疫肿瘤分类(EGIC),以指导患者一线免疫治疗选择。
发现 ESCC 基因组特征
分析 JUPITER-06 研究治疗组和对照组 WES 数据,系统评估免疫原性和特异性基因异常事件相关的基因组特征,发现 35 种显著突变基因(SMGs),其中最常见的是 TP53(93%),NOTCH1(31%),KMT2D(20%),CDKN2A(15%)和 PIK3CA。
数据还发现多种体细胞拷贝数异常(CNA),其中染色体 3q26.33,3q29 和 6p21.32 扩增最常见,而染色体 11q12.2,11q14.3 和 11p15.4 缺失最常见。
单碱基替换(SBS)包括 5 种突变特征,显示 ESCC 的主要诱变因素是载脂蛋白 B mRNA 编辑酶活性,胞苷脱氨酶催化多肽(APOBEC)家族,老化,DNA 错配修复缺陷,烟草暴露和酒精暴露。全基因组加倍(WGD)则见于 78.8% 的患者。
预测免疫联合化疗治疗疗效标志物
1、ccTMB
肿瘤突变负荷(TMB),克隆 TMB,APOBEC 特征等肿瘤免疫原性指标对于免疫联合化疗疗效预测价值有限。因此,研究通过对 CNA 早期突变,无 CNA 的突变和杂合性缺失(LOH)突变等加和得到 CNA 校正 TMB(ccTMB)作为改良克隆 TMB 标准(图 1)。
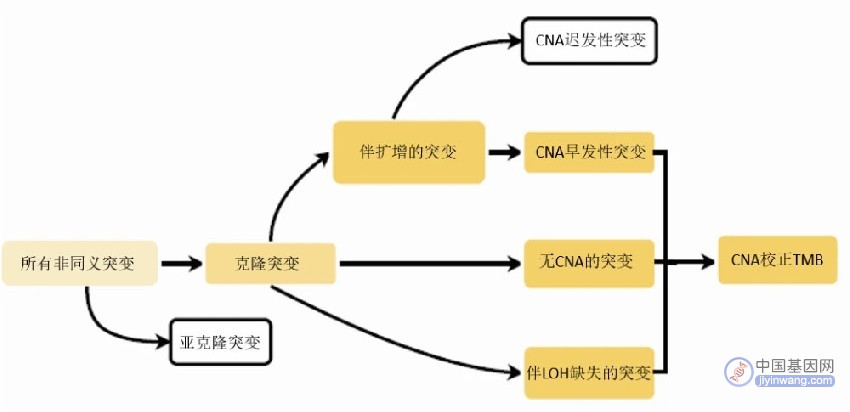
图 1 ccTMB 计算流程图
将 ESCC 患者分为高 ccTMB 和低 ccTMB 组,发现和低 ccTMB 患者相比,高 ccTMB 患者接受化疗+PD-1 抑制剂较单纯化疗具有更显著的总生存(OS)改善(HR 0.29 vs 0.70,图 2)和无进展生存期(PFS)改善。
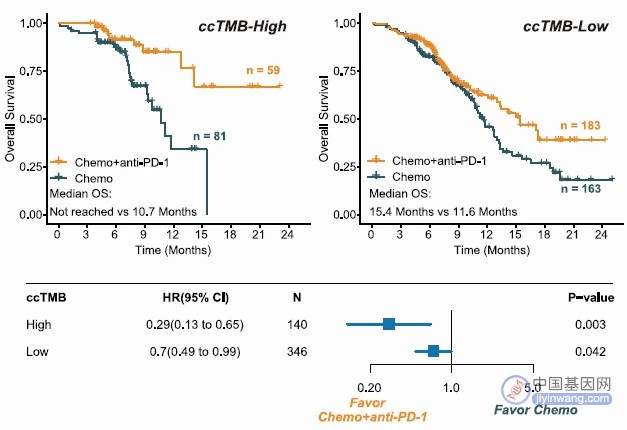
图 2 不同 ccTMB 患者接受免疫联合化疗的 OS
同时发现 ccTMB 状态和 PD-L1 状态无显著相关性,表明 ccTMB 可作为独立生物标志物预测化疗+PD-1 抑制剂治疗获益。
2、HLA 基因型
研究同时还发现 85% 的患者人类白细胞抗原(HLA)-Ⅰ的胚系或体细胞杂合性降低,32.1% 的患者 HLA-Ⅱ的胚系杂合性降低,这些都和接受免疫联合化疗的 PFS 和 OS 获益降低有关(图 3)。
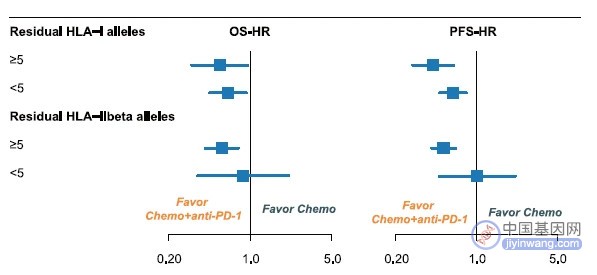
图 3 HLA 和免疫联合化疗获益相关
行 HLA-A 和 HLA-B 超分型后,发现 B62 超分型的存在是免疫联合化疗生存获益的最强预测因子。进一步将 B62 超级分型 ESCC 患者分为 B62-B1501 和 B62-非 B1501 亚组,发现 B62-B1501 和免疫联合化疗更少的 OS 和 PFS 获益相关,而 B62-非 B1501 和方案更好的结局相关(图 4)。
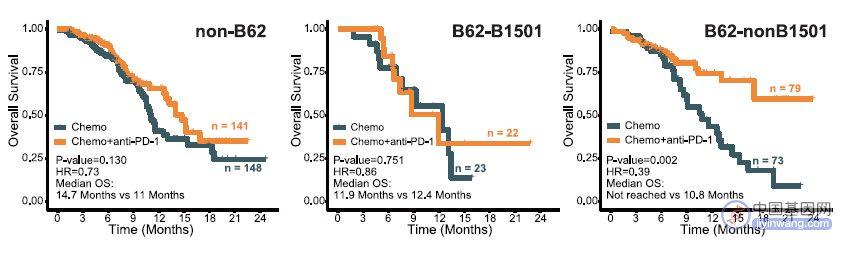
图 4 B62 超分型和免疫联合化疗结局相关
进一步整合 ccTMB 和 HLA 相关特征以改善患者选择。研究将高 ccTMB,HLA-B 杂合性/HLA-Ⅱβ 多样性,B62-非 B1501 超亚型作为 3 个良好免疫原性特征,将至少具有 2 个特征的患者(48.8%)定义为免疫原性特征良好型,其余为免疫原性不良患者。
整合之后的预测效率显著改善。免疫原性特征良好患者接受免疫联合化疗较免疫原性特征不良患者具有显著更高的 OS 和 PFS 获益。免疫原性特征良好组接受免疫联合化疗的 12 个月 PFS 率达到 46.7%,是接受单纯化疗的特征良好患者的 6.4 倍(12 个月 PFS 率 7.3%),是特征不良组接受化疗 ±PD-1 抑制剂的 2.4 倍(12 个月 PFS 率 13.9%)。
3、癌基因异常
筛查所有 SMGs 后,发现 TET2 和 PIK3CA 突变和免疫联合化疗更少的获益相关。筛查复发性体细胞 CNAs,发现高度 22q11.21 和 1q21.3 扩增水平和免疫联合化疗缺乏获益显著相关。
此外,此队列中 54.1%ESCC 患者具有至少 1 个可预测免疫联合化疗耐药的风险癌基因异常(如 PIK3CA 突变,TET2 突变,22q11.21 高水平扩增,1q21.3 高水平扩增)。需要注意的是,至少 1 个风险癌基因事件的患者从免疫联合化疗中获益显著更少。之后探索是否癌基因异常也和抗 PD-1 单药疗效相关。
由于 PIK3CA/TET2 突变和胃癌的 EB 病毒(EBV)阳性状态和高度微卫星不稳定(MSI-H)强相关,仅纳入胃癌数据库中 EBV 阴性和微卫星稳定(MSS)患者分析。联合黑色素瘤数据集和肾细胞癌数据集,验证多种癌症类型中,携带至少 1 个风险癌基因异常的患者从免疫联合化疗中获益更少。
综合免疫原性和癌基因特征,EGIC 分型预测免疫治疗结局
前述免疫原性特征(高 ccTMB,HLA-Ⅰ/Ⅱ多样性,B62-非 1501 超亚型)和风险癌基因异常(PIK3CA 突变,TET2 突变,22q11.21 高水平扩增和 1q21.3 高水平扩增)代表调节 ESCC 免疫联合化疗疗效的 2 个独立方面。
EGIC 分型通过整合 2 个特征,将 ESCC 患者分为 3 组:
EGIC1(免疫原性特征良好及风险事件阴性);
EGIC2(免疫原性特征良好或风险事件阴性);
EGIC3(免疫原性特征不良及风险事件阳性)。
EGIC 分型在鉴别患者从免疫联合化疗中有或无 OS 获益具有良好表现(图 5):
EGIC1 型患者接受免疫联合化疗具有最佳 OS 改善(HR 0.23,P = 0.001);
EGIC2 型患者接受免疫联合化疗较单纯化疗具有 OS 改善,但改善程度不及 EGIC1 组(HR 0.50,P = 0.004);
EGIC3 型患者从免疫联合化疗中无显著 OS 获益(HR 1.22,P = 0.451)。
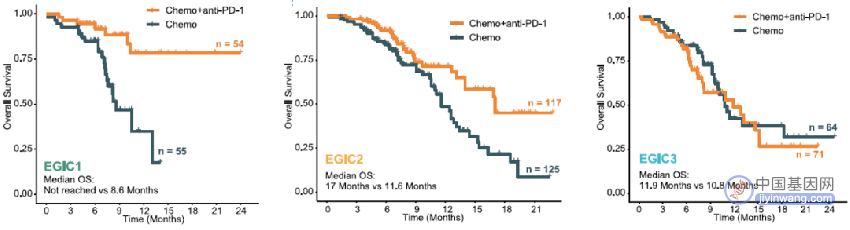
图 5 不同 EGIC 分型患者接受免疫联合化疗治疗的结局
小结
研究通过对 JUPITER-06 研究患者行 WES 数据整合分析,发现可区分免疫联合化疗对比单纯化疗结局的基因特征,进一步发展出可指导晚期 ESCC 患者个体化治疗的 EGIC 分型。
这是首个在随机对照研究中进行基因组层面生物标志物的研究。研究发现多种免疫癌基因特征是预测患者接受一线免疫联合化疗结局的可靠生物标志物,对于患者治疗选择具有重要意义,并为肿瘤免疫未来的生物学研究和新型治疗策略奠定了道路。
参考文献
Chen YX, et al. An immunogenic and oncogenic feature-based classification for chemotherapy plus PD-1 blockade in advanced esophageal squamous cell carcinoma. Cancer Cell. 2023;S1535-6108(23)00089-2.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。