细胞基因治疗技术的发展历程与趋势
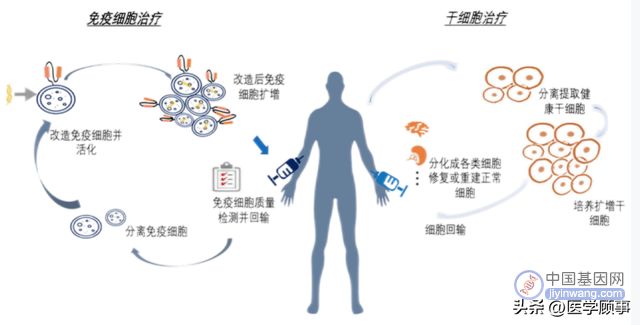
细胞基因技术(CGT,Cellular and Gene Therapy)是指将确定的遗传物质转移至患者的特定靶细胞内,通过基因添加、基因修正、基因沉默等方式修饰个体基因的表达或修复异常基因,达到治愈疾病目的的过程。

细胞基因治疗的优势
01、针对性强
治疗肿瘤针对性强,具有很高的靶向性,效果显着,在杀伤癌细胞时基本上不损伤正常组织。
02、作用机制独特
具有非细胞毒性,效果显著、无毒和好的耐受性。
03、副作用和不良反应少
与传统手术及放、化疗方法相比,基本无副作用和不良反应,治疗过程中病人不会产生痛苦。
细胞基因治疗发展历程
2002年:2002年启动针对严重免疫缺陷病儿童的基因治疗。
2012年:2012年Glybera成为第一个在欧洲获批上 市的基因药物。
2016年:2016年干细胞基因疗法Strimvelis获批治疗ADA。
1990s:ADA(腺苷脱氨酶)缺陷病人 1990年首次治愈。
2009年:2009年转基因疗法治疗帕金森病人提高多巴胺合成功能。
2014年:2014年基因治疗HIV病人首次取得成果。
2019年:2019年基因治疗药物Zolgensma获批治疗SMA。
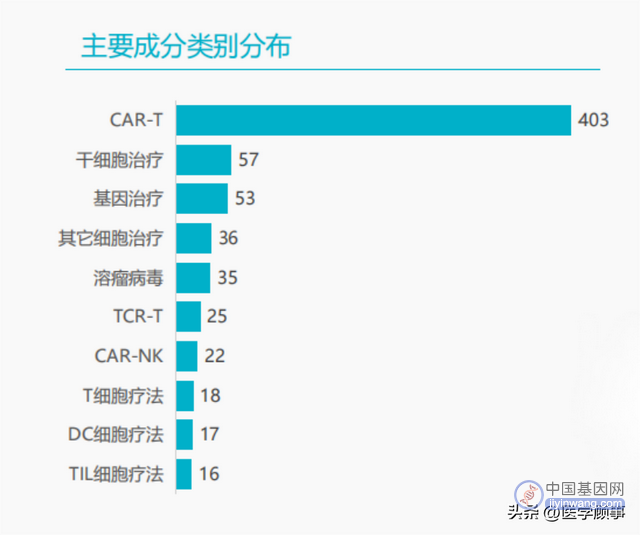
全球在研药物管线
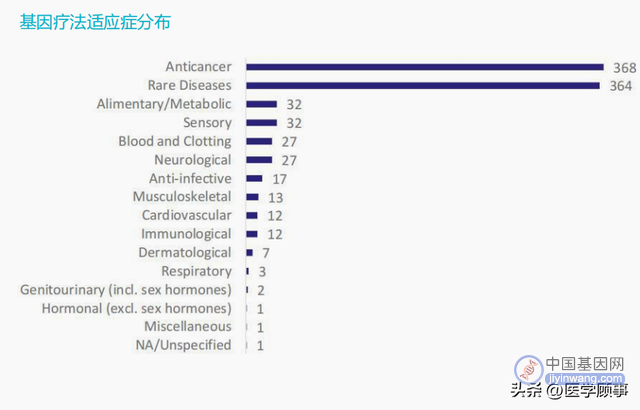
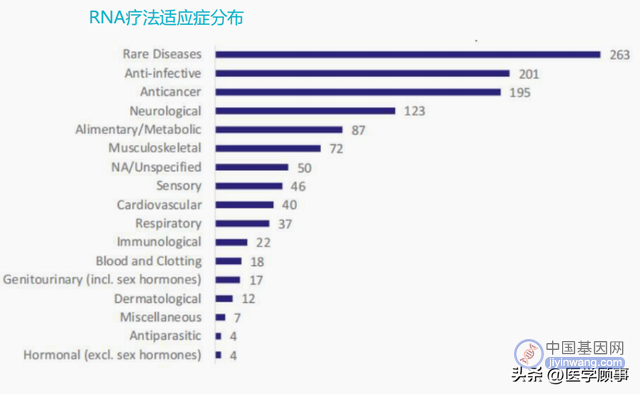
据ASCGT数据,全球3633项CGT临床试验中,2024项为基因治疗管线,包括CAR-T疗法在内的基因编辑,占比为55%;803项为不涉及基因编辑的细胞治疗管线,占比为22%。
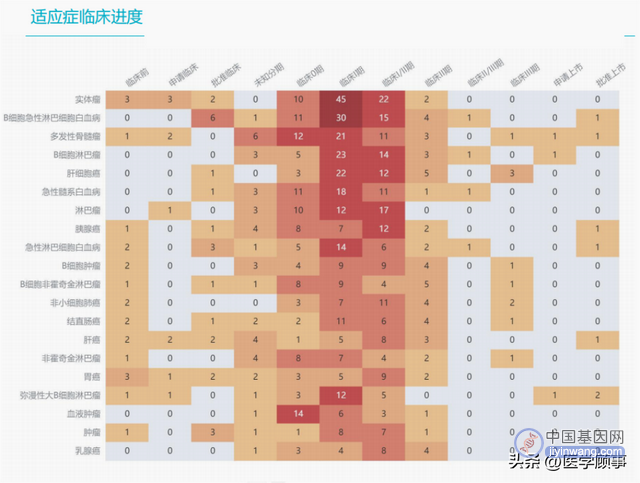
全球在研药物管线
中国CGT药物临床在研管线700余项,除上市5款外,申请上市的2项,I期临床259项,II期临床233项,III期临床20项,批准临床26项,申请临床52项。
全球及国内CGT市场规模预测
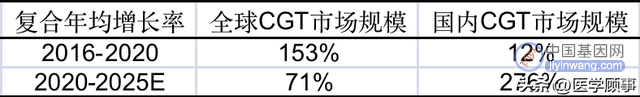
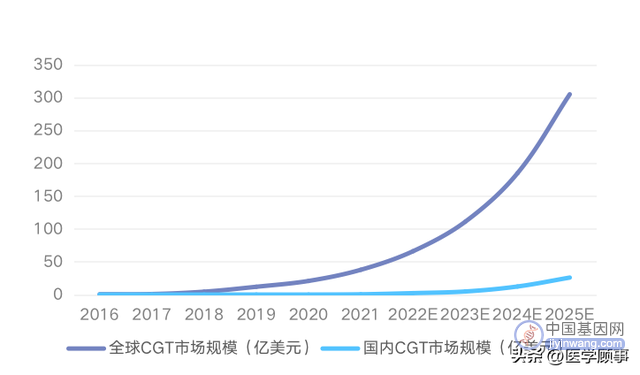
数据来源于:弗若斯特沙利文咨询(中国)
国内市场在2016-2020年期间,年复合增长率为12.2%,2020年市场规模为2380万元,虽然中国市场起步较晚,但预计在政策推动、医学技术进步、患者人数增加等多重因素影响下,2025年有望激增到178.85亿元,该赛道具有极大的潜力。
各国CGT监管政策
美国
美国是基因细胞治疗领域的先驱,监管体系完整且更为保守、谨慎。2017年FDA才批准首款基因治疗产品,比欧盟晚了5年。早于1984年,美国即提出对CGT行业进行监管,由NIH和FDA开展双监管。自1999年发生杰西死亡事故后,美国加强行业监管,FDA和NIH先后颁布多项CGT行业监管法令。2018年为了推动行业发展,FDA重启发布3份针对特定疾病(血友病、视网膜病、罕见病)的开发新指南,并更新了3个现有指南,以解决与基因细胞疗法相关的生产问题。
欧盟
欧盟是由欧盟药物管理局 (European MedicinesAgency, EMA) 对CGT按照人用药品进行管理。将基因治疗、细胞治疗产品和组织工程产品定义为先进医疗产品 (Advanced Therapy Medicinal Produces, ATMP) ,对基因细胞治疗按照药品申报,由EMA下设的ATMP委员会审评,审评意见提交人用药品委员会CHMP (Committee for Medicinal Products for Human Use) 作出最后决议,最终由EMA批准。至今,欧盟已颁布了多项与安全性监管相关的指导原则。
中国
中国在CGT领域的基础研究和临床试验方面开展相对较早,监管政策法规相对滞后,内容较简单。对相关研究开发的多个环节所涉及的具体问题没有详细说明和规定,法规约束性不强,审批相对宽松。2018年,受 “世界首例基因编辑婴儿事件”影响,我国开始加强生物安全、基因技术和生物医学等领域的立法。2019年颁布《生物安全法》、《中华人民共和国人类资源遗传管理条例》,2020将基因编辑、克隆人类胚胎植入人体或动物体内的行为列入刑法,“情节严重的,处三年以下有期徒刑或者拘役,并处罚金;情节特别严重的,处三年以上七年以下有期徒刑,并处罚金”2021年施行的《民法典》也明确表明 “从事与人体基因、人体胚胎等有关的医学和科研活动,应当遵守法律、行政法规和国家有关规定,不得危害人体健康,不得违背伦理道德,不得损害公共利益。”从监管层面明显趋严及更加规范。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。