癌症的体内基因免疫治疗策略:靶向免疫细胞或靶向肿瘤细胞
#癌症#越来越多地被理解为是一种免疫功能低下的疾病,其异质性强调了对个性化细胞疗法的需求。人们对于癌症免疫疗法理解的加深引起包括免疫检查点抑制剂(ICI)、溶瘤病毒 (OVs) 和嵌合抗原受体 (CAR) -T在内的多种新型疗法的开发。与此同时,核酸的设计、安全性、特异性和递送方面的突破使我们更接近核酸治疗的时代。
近日,来自宾夕法尼亚大学的Neil C. Sheppard等人在Science Translational Medicine杂志上发表了一篇题为 In vivo gene immunotherapy for cancer 的综述,在这篇文章中,他们介绍了体内基因免疫治疗的两种主要策略的临床转化和发展:即靶向免疫细胞或肿瘤细胞(图1),就前者而言,主要使用病毒载体和mRNA来传递治疗基因,而后者则使用包装在纳米颗粒 (NPs) 中的OVs或mRNA传递免疫调节相关基因,并结合RNAi来对抗肿瘤免疫抑制因子。然而,体内疗法可能限制了监测和分析治疗性细胞群的能力,因而对改进的靶向载体、靶向基因操作和瞬时转导系统的研究为解决这些问题提供了可能的解决方案。

对抗癌症的一个核心和长期挑战是缺乏免疫细胞与癌细胞的接触。由于癌细胞本质上是自体衍生的,因此它们的可靶向表面蛋白通常是那些被选择用于免疫反应以防止自身免疫的表面蛋白,它们还会下调MHC表达来逃避免疫系统的追杀。因此,增加内源性免疫细胞抗肿瘤参与的有效方法是以不依赖 MHC 的方式赋予它们特定于所需肿瘤抗原的受体,例如CAR。此外,下游挑战是由于慢性激活信号传导后进行性分化或肿瘤向抗炎状态直接重编程导致的免疫功能减退,减轻这种情况的一种潜在策略是调节支持促炎表型、保留记忆亚群和维持干性的因素。目前在体内对免疫细胞进行功能性重编程的方法利用靶向病毒载体进行基因持久编辑或靶向NPs进行瞬时编辑,下面将对这两种方法进行简要介绍。
一、靶向体内免疫细胞
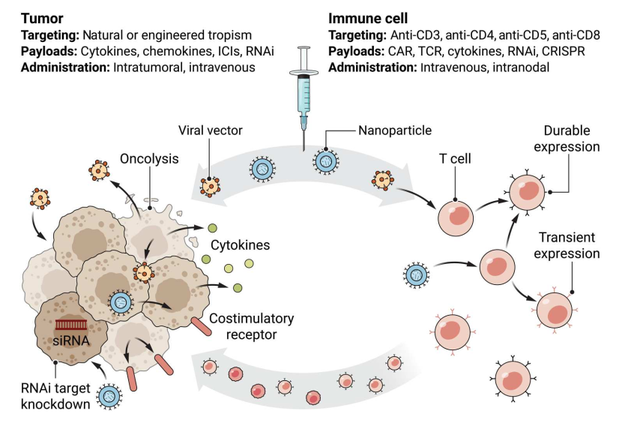
图1. 靶向免疫细胞或肿瘤细胞进行体内基因免疫治疗
1. 靶向病毒载体
抗原重定向T细胞的离体制造依赖于水泡性口炎病毒(VSV)G蛋白假病毒(LV)或γ逆转录病毒转导来传递 CAR、TCR 或类似的外源受体,近年来适合体内靶向转导的病毒的工程化得到了进一步的发展。对于慢病毒系统,可以通过副粘病毒或甲病毒假型来实现,它们的受体结合和膜融合结构域是分开的,允许将受体结合部分替换为指定的靶向配体,比如Buchholz团队率先通过使用CD8靶向LV,进入T细胞以传递识别黑色素瘤抗原酪氨酸酶的TCR。然而,体内病毒载体的瓶颈在于疫苗或感染诱导的对包膜蛋白或病毒衣壳的免疫以中和抗体或 T 细胞的形式存在,因此必须首先克服这一点。
2. 靶向生物材料
需要注意的是,病毒载体插入肿瘤发生的部位以及引起的内源性免疫反应,可能会减弱基因递送并引发炎症。因此,一种新兴的替代方法是使用基于生物材料的载体和NPs,它们可以针对特定的细胞向性和免疫反应性进行设计。NPs直径小于1 μm,由有机分子(如脂质和聚合物)或无机分子(如金和其他金属或金属化合物)组成,通过选择转基因mRNA、RNAi或基因组编辑机器以分别实现暂时性或永久表达。最近的工作强调了脂质NPs(LNPs)可以作为多种核酸(如siRNAs和mRNAs)载体。一项关键工作是Rurik及其同事报道了其首次应用于体内基因免疫治疗,即设计了含有重编程T细胞所需mRNA的CD5靶向LNPs,在体内产生治疗性的CAR-T细胞,改善了心力衰竭小鼠模型的心脏功能。此外,随着核苷酸递送策略的进步,一个新兴方法是将RNAi与mRNA共同递送,这样免疫原因子的增强表达就可以与各种免疫反应负性调节因子的沉默相结合,可能成为免疫细胞体内编辑的更理想方式。
当然,NPs递送技术的进一步研究和优化以及改进病毒基因转移方法不仅可以用于编辑免疫细胞,还可以用于调节肿瘤。
二、靶向肿瘤细胞
第一个癌症体内基因治疗试验是基于使用脂质复合物将HLA-B7引入HLA-B7 阴性黑色素瘤患者的病灶。尽管纠正驱动肿瘤的基因异常是一种有效的方法,但免疫治疗方法可能更容易处理,因为许多方法只需要细胞质而不是核递送,并且可以通过非靶向病灶的远位效应产生益处。迄今为止,OVs的临床研究相较于RNAi和mRNA而言更为活跃,但每种策略都在不断取得进展,都有可能成为癌症体内基因免疫疗法未来的贡献者。
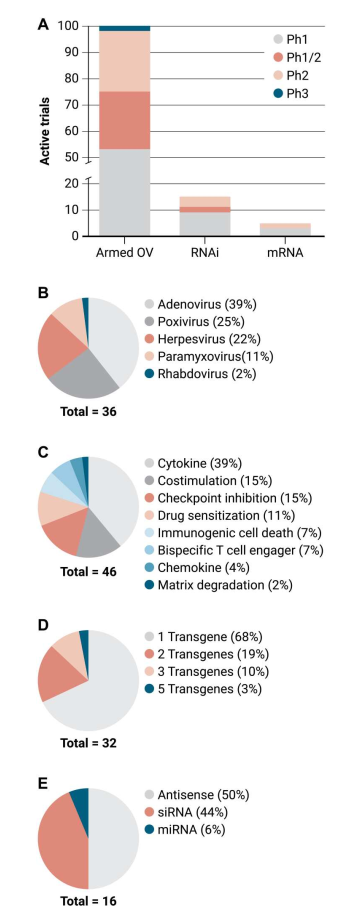
图2. 肿瘤靶向基因免疫治疗策略的临床概况
1. 溶瘤病毒(OVs)疗法
尽管宿主的免疫系统通常可以保护肿瘤免受感染,但自1880年代以来已经观察到与病毒感染相关的自发性肿瘤消退。最近有报道称,由于严重急性呼吸综合征冠状病毒2感染导致癌症患者缓解。病毒感染的抗肿瘤益处仅部分归因于直接溶瘤作用,主要益处由宿主的免疫反应驱动,包括病毒和肿瘤特异性成分。肿瘤细胞的病毒感染导致免疫原性细胞死亡,释放损伤和病原体相关的分子模式(分别为DAMPs和PAMPs),刺激宿主的模式识别受体。OVs领域一直在努力利用病毒的抗肿瘤特性,同时通过选择或设计用于肿瘤限制复制或转基因表达的病毒来最大限度地降低对健康组织的风险。
截至目前,“武装”的OVs正在进行100多项试验,其中IMLYGIC(由GM-CSF武装的OVs)联合PD-1 ICI在肉瘤和黑色素瘤中的研究取得了可喜的结果。然而,包括激活肿瘤特异性启动子所需的因素以及中和抗体和先天免疫反应的影响等问题成为OVs应用的限制因素,因而选择合适患者的生物标志物方法以及扩大OV肿瘤趋向性和基因表达程序可能会部分解决上述问题。此外,关于肿瘤靶向,通过全身或局部途径递送的OVs的局限性之一是,与肿瘤内注射相比,只有少量输注的病毒到达肿瘤病变,大部分被肝脏等汇清除。因此,可以在腺病毒OVs的衣壳中加入肿瘤靶向肽,在临床前模型中,这种操作引起的肿瘤与肝脏的比例比未修饰的OVs高5000倍。
2. mRNA疗法
相对于OVs,mRNA基因免疫疗法具有明显的优势,但由于它依赖于NPs进行递送,因此是一个相对较新的领域,目前只有五项活跃的临床研究并且尚未发表临床数据。最近的几项研究表明,使用LNP包封的IL-12 mRNA在各种肿瘤模型中具有良好的抗肿瘤功效,推动临床试验将其用作单一疗法、与ICI组合或作为几种mRNA混合物的一部分。如果进一步研究确定了由NPs转染的细胞类型的分布并减轻NPs诱导的潜在抗治疗辅助反应,mRNA基因免疫疗法可能会成为癌症和其他应用的重要模式。
3. RNAi疗法
RNAi是使用非编码核酸在转录水平调节基因表达的治疗方法的总称。siRNA和shRNA利用细胞的内源性miRNA机制,通过双链RNA特异性核糖核酸内切酶DICER与RISC和Argonaute 2结合以介导翻译抑制。miRNA可以使用“种子序列”一次调节多个基因,降解完美匹配的靶标或隔离不完美匹配的靶标。双功能shRNA可以利用miRNA的两种特性对靶蛋白表达产生更快速和持久的影响。反义寡核苷酸(ASO)具有三种不同的作用机制。在细胞核中,与mRNA配对的ASO会导致核糖核酸酶H1介导的降解,与pre-mRNA配对的ASO会改变剪接;在胞质中,ASO通过靶向mRNA翻译起始密码子引起翻译停滞。
迄今为止,适合全身给药的六种ASO和四种siRNA疗法已被美国和欧洲监管机构批准用于治疗各种罕见疾病。相比之下,尽管有33个癌症RNAi候选者进入临床,但没有一个达到3期试验,15个处于暂停中,其中的11个因缺乏疗效而被放弃,其余4个则已因未公开的原因被暂停。在18个正处于活跃试验阶段的候选RNAi,9个靶向肿瘤驱动因子、致癌信号传导或细胞凋亡抗性途径和9个具有主要或至少显着免疫抑制作用的靶因子。
与递送至免疫细胞相比,使用NPs将RNA递送至实体瘤面临明显的障碍。幸运的是,实体瘤血管系统改变引起的增强渗透和保留效应增强了包裹在NPs中的ASO和RNA的传递。用可电离脂质设计的NP在由肿瘤Warburg代谢产生的酸性微环境中带电,从而导致更高的细胞穿透潜力。此外,通过控制NPs的大小、形状和电荷,并通过PEG分子或肿瘤受体配体进行表面修饰,可以合理设计RNA-NPs制剂以实现低免疫原性和靶向递送。由于一些NPs修饰(例如PEG化)提高了血清半衰期但降低了穿透性,最近的NP已被设计为允许在肿瘤微环境中过表达的基质金属蛋白酶将PEG从PEG化的NPs上切割下来并暴露细胞穿透肽以增强肿瘤细胞的递送。至于联合疗法,目前有几种正在与其他免疫疗法进行联合研究,例如FoxP3靶向ASOAZD8701正在与PD-L1ICI (NCT04504669) 联合进行测试,TGF-β1靶向ASOTASO-001正在与IL-2 (NCT04862767) 联合测试等。
三、展望
2017年,FDA批准了首个用于遗传疾病的体内基因疗法Luxturna,恰逢FDA批准了首个体外制造的基于细胞的基因疗法Kymriah,用于治疗难治性白血病。开发基于细胞的疗法仍然具有挑战性,因为缺乏高质量的模型来评估复杂疗法在人体研究之前或响应于人体研究的安全性和有效性。除了规避中和抗体反应外,还有脱靶可能。CAR-T细胞免疫疗法已经改变了几种血液系统恶性肿瘤的治疗方式,体内基因转移技术的不断进步有可能通过简化工作流程使免疫细胞疗法更广泛地应用。此外,这些方法将使医生能够同时重定向和武装多个谱系的免疫细胞(例如,T细胞、NK细胞、NKT细胞和巨噬细胞)以对抗患者的肿瘤。
原文链接:http://doi.org/10.1126/scitranslmed.abo3603
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。