科学家破解「不老神兽」长寿基因,并成功迁移用于家鼠,将后者寿命延长约4.4%
“毫无疑问,这是一项令人振奋的开创性长寿研究,不仅揭示了高分子量透明质酸在健康长寿中的重要作用,也开辟了一种有望用于人类健康和干预疾病的新方法。”对于由山东大学本科校友、美国罗彻斯特大学博士、哈佛医学院博士后田骁担任共同作者的 Nature 论文,评审专家予以高度评价。
在这项研究中,他和合作者首次将裸鼹鼠自然演化而来的长寿机制,成功转化到小鼠身上,并证实这一转化能起到类似的抗癌和延寿效果。

▲图 | 田骁(来源:田骁)
01
关于长寿,自然界似乎已经准备好答案
随着医疗水平的提高,人类的寿命也在逐步延长。但是,越来越多的老年人受到老年病的困扰,比如阿尔兹海默症、帕金森症、糖尿病、脑梗、心梗等。人们普遍渴望长寿,但真正值得追求的是在健康状态下实现长寿,并减少疾病的发生。为了达到这一理想状态,我们必须深入了解衰老的调控机制。
衰老被认为是引发老年病的根本原因。尽管如此,人类目前对于衰老这一问题显然并没有很好的答案。然而,自然界似乎已经为我们准备好了解决方案,只等待我们去探索和发现。
裸鼹鼠(Heterocephalus glaber),就是一种可以给人类提供重要线索的长寿物种。家鼠是和裸鼹鼠体型相似的近亲。但是,家鼠的寿命只有三年,裸鼹鼠则拥有长达四十年以上的超长寿命。
而且,裸鼹鼠并不会像人类一样会因为活得久而患上各种老年病。比如,在老年裸鼹鼠之中很少发现有癌症的存在。
过去十三年间,田骁一直在研究裸鼹鼠的长寿机制和抗癌机制。2013 年,他以第一作者身份,和同实验室的另外两位博士生克里斯托弗·海纳(Chirstopher Hine)以及豪尔赫·阿兹普鲁阿(Jorge Azpurua)一起在 Nature 发表封面论文,揭示了在裸鼹鼠细胞和组织中发现的抗癌机制——高分子量透明质酸(俗称玻尿酸)[1]。

(来源:Nature)
基于不同的分子量,透明质酸会产生不同的生物属性。不同于医美注射所用的玻尿酸,裸鼹鼠细胞分泌的透明质酸拥有超高的分子量。这种高分子量的透明质酸具有抗癌属性,并能有效地清除氧自由基,因此具有抗炎症的作用。
考虑到这种抗癌机制是裸鼹鼠几千万年长寿演化的结果,而细胞衰老导致的突变增加是产生癌症的主要原因。所以,田骁和同事预估高分子量透明质酸,可能会对裸鼹鼠的长寿也起到重要贡献。
同样在 2013 年,田骁决定构建一个小鼠模型,来测试能否将这种机制横向转移到其他物种中,以及能否同样起到抗癌和延长寿命的效果。
构建崭新的小鼠模型是一项长期工程。经过五年多的研究,他和同事终于构建了一个转基因小鼠。这款转基因小鼠的特点在于,它携有裸鼹鼠用于合成高分子量透明质酸基因(nmrHAS2)。
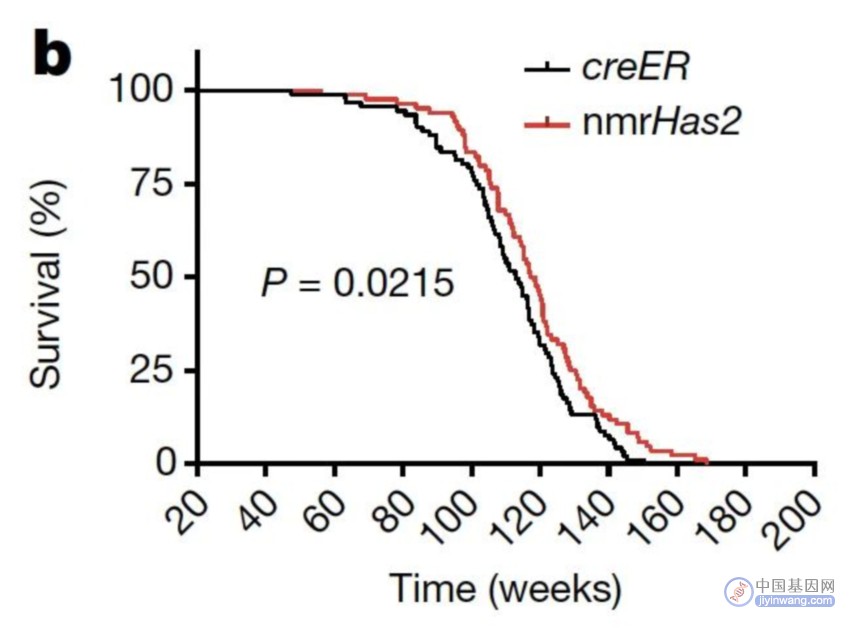
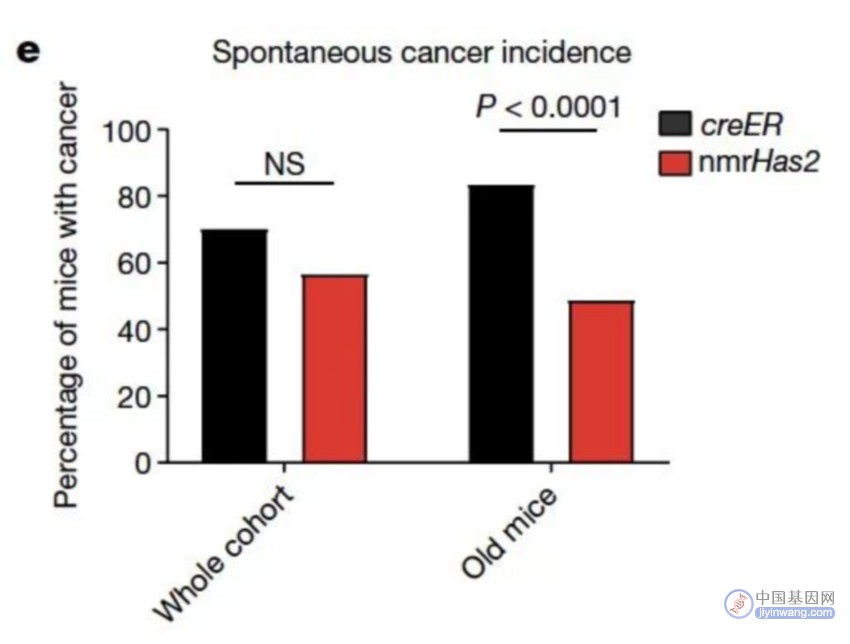
结果发现,转基因小鼠患癌发生率得到显著降低,寿命也变得更长[2]。具体而言,转基因小鼠表现出多维度的年轻性状,包括甲基化寿命变低、衰弱指数降低、炎症水平降低、肠道屏障功能增强等。
(来源:Nature)
从 2013 年建立小鼠模型,到获得小鼠的寿命数据和癌症数据,再到探索分子机制前后历经十年时间。其中,在 2018 年他们得到了小鼠的寿命曲线和癌症数据,这为机制研究指明了方向。
从裸鼹鼠身上,田骁和同事不仅发现了高分子量透明质酸,还发现许多其他可以抵抗细胞衰老和抗癌的新机制。
通过利用包括裸鼹鼠在内的多达 20 多种的啮齿类物种,他发现那些长寿的物种普遍具有更强的 DNA 双链断裂修复(double-strand break repair)能力[4]、精密调控细胞端粒以及细胞分裂的能力[5],并能演化出新型抗癌基因[6]、以及抑制已知的衰老通路[7]。

(来源:Cell)
继 2013 年那篇 Nature 论文之后,田骁和同事的又一篇新论文再次发表于 Nature。本次论文的题目为《裸鼹鼠 Has2 增加透明质酸可改善小鼠的健康寿命》(Increased hyaluronan by naked mole-rat Has2 improves healthspan in mice)。罗切斯特大学博士生张智辉是第一作者,罗彻斯特大学安德烈·塞卢阿诺夫(Andrei Seluanov)教授和维拉·戈尔布诺娃(Vera Gorbunova)教授担任共同通讯作者[2]。

▲图 | 相关论文(来源:Nature)
透明质酸具有很强的生物可容性,这一点已经在医美行业得到证实。这种天然的高安全性优势,为其在生物医疗领域的转化提供了便利。
在不久的将来,经过纯化之后的裸鼹鼠透明质酸,有望通过微注射等方式导入人体器官和组织内部,从而发挥抗炎、抗氧化、抗癌、延缓细胞和组织衰老等功能。
另外,基于高分子量透明质酸的特殊抗癌属性,它还有可能会被直接用于治疗癌症。关于这一点,国内已经有实验室在开展探索[3]。
02
“世界上第一个看到某个现象的人”
除了本次发表的 Nature 论文之外,田骁还曾以一作身份在 Nature、 Cell、 PNAS、Philosophical Transaction 等期刊发表论文。
其表示:“科研的每一步都是站在巨人的肩膀上。借此机会我也向领域内的各位前辈致谢,没有他们的前期成果也许我们会错过这项发现。”
也许有人觉得科研是枯燥无味的,但是田骁非常享受科研。“因为你很有可能是世界上第一个看到某个现象的人。每一次学习新的实验技术、拿到新的实验数据,都会激发我思考这些新发现的意义以及下一步的方向。”他说。
“假如你见到一个寿命长达上千年并且不会得老年病的外星生物,你会不由自主地好奇他是怎么办到的。把裸鼹鼠放在手中,我的感受正是如此,因为它们是比同体型的近亲物种寿命高出十几倍的神奇存在。很多我们习以为常的现象比如疾病、衰老,可能会有另外一种结果。而裸鼹鼠就是一个摆在我们面前的生动例证。”田骁继续说道。
如何将高分子量透明质酸,安全地转化到人体组织之内,并探索其能否起到相似的效果将是个富有意义的探索。
当然,人类透明质酸的代谢,和裸鼹鼠以及实验小鼠的并不相同。人类下游信号的通路,也有可能有别于裸鼹鼠和实验小鼠。因此前路依旧漫漫,任重而又道远。
另据悉,田骁出生于山东省潍坊市昌乐县,本科就读于山东大学生命科学学院。本科毕业以后,他来到上海巴斯德研究所做了一年的实验室研究助理。
自 2010 年起,他在美国罗彻斯特大学读完六年博士并做了两年的博士后研究。2018 年,他又加入美国哈佛大学医学院从事博士后工作,期间主要探索如何将衰老细胞,通过重编程方式对其衰老进行逆转,并使其重新获得健康细胞的功能[8]。
2024 年 1 月份,他将在美国桑福德伯纳姆普利贝斯医学研究所(桑福德所,Sanford Burnham Prebys Medical Discovery Institute)独立建组,日后将重点研究人体衰老的机制,并试图从长寿物种中寻找延长健康寿命的方法。
田骁表示:“桑福德所在癌症和衰老领域有着丰富的研究经验和深厚的学术积淀。未来我在这里将继续从事衰老研究,并探索衰老引发老年病的具体机制。”
具体来说,他将以表观遗传衰老为切入点,尝试探索新的干预方式从而达到延缓衰老和降低疾病风险的目的。即以多组学研究为手段包括采用基因组学、转录组学、表观遗传组学和蛋白组学等手段,深入探究不同细胞和组织的衰老特性并找到干预靶点。
其实验室详细研究方向请参考 www.xiaotianlab.org。有对衰老研究感兴趣的本科生读者和研究生读者,可以报考该实验室或申请博士后工作(xiaotian@sbp.edu)。详见https://sbpdiscovery.hrmdirect.com/employment/job-opening.php?req=2788211&&&nohd#job
参考资料:
1.Tian, X., Azpurua, J., Hine, C., Vaidya, A., Myakishev-Rempel, M., Ablaeva, J., Mao, Z., Nevo, E., Gorbunova, V., and Seluanov, A. (2013). High-molecular-mass hyaluronan mediates the cancer resistance of the naked mole rat. Nature 499, 346-349. 10.1038/nature12234.
2.Zhang, Z., Tian, X., Lu, J.Y., Boit, K., Ablaeva, J., Zakusilo, F.T., Emmrich, S., Firsanov, D., Rydkina, E., Biashad, S.A., et al. (2023). Increased hyaluronan by naked mole-rat Has2 improves healthspan in mice. Nature 621, 196-205. 10.1038/s41586-023-06463-0.
3.Zhao, Y., Qiao, S., Hou, X., Tian, H., Deng, S., Ye, K., Nie, Y., Chen, X., Yan, H., and Tian, W. (2019). Bioengineered tumor microenvironments with naked mole rats high-molecular-weight hyaluronan induces apoptosis in breast cancer cells. Oncogene 38, 4297-4309. 10.1038/s41388-019-0719-4.
4.Tian, X., Firsanov, D., Zhang, Z., Cheng, Y., Luo, L., Tombline, G., Tan, R., Simon, M., Henderson, S., Steffan, J., et al. (2019). SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species. Cell 177, 622-638 e622. 10.1016/j.cell.2019.03.043.
5. Tian, X., Doerig, K., Park, R., Can Ran Qin, A., Hwang, C., Neary, A., Gilbert, M., Seluanov, A., and Gorbunova, V. (2018). Evolution of telomere maintenance and tumour suppressor mechanisms across mammals. Philosophical transactions of the Royal Society of London. Series B, Biological sciences 373. 10.1098/rstb.2016.0443.
6.Tian, X., Azpurua, J., Ke, Z., Augereau, A., Zhang, Z.D., Vijg, J., Gladyshev, V.N., Gorbunova, V., and Seluanov, A. (2015). INK4 locus of the tumor-resistant rodent, the naked mole rat, expresses a functional p15/p16 hybrid isoform. Proceedings of the National Academy of Sciences of the United States of America 112, 1053-1058. 10.1073/pnas.1418203112.
7.Tian, X., Seluanov, A., and Gorbunova, V. (2017). Molecular Mechanisms Determining Lifespan in Short- and Long-Lived Species. Trends in endocrinology and metabolism: TEM 28, 722-734. 10.1016/j.tem.2017.07.004.
8.Lu, Y., Brommer, B., Tian, X., Krishnan, A., Meer, M., Wang, C., Vera, D.L., Zeng, Q., Yu, D., Bonkowski, M.S., et al. (2020). Reprogramming to recover youthful epigenetic information and restore vision. Nature 588, 124-129. 10.1038/s41586-020-2975-4.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。