“格鲁特”重生:2022年异基因干细胞移植进展
导读
异基因造血干细胞移植是“再生医学”的典范之一,供者的造血干细胞“种子”如何适应受者的骨髓微环境“土壤”,克服免疫屏障生根发芽?茁壮发育的“新苗”如何克服“成长的烦恼”,解决“移植物抗宿主病”与新环境和谐共处?重建的造血和免疫系统已经“枝繁叶茂”地成长为“树人”格鲁特,面对强疾顽敌,如何在“细胞治疗护卫队”其他朋友的相助下发挥最大的力量治愈疾病?本文将主要讲述2022年异基因造血干细胞移植的关键进展。
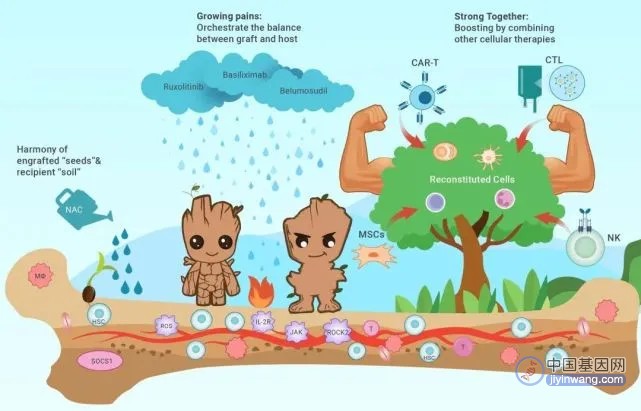
图1 重生“格鲁特”治愈世界
促进造血干细胞“种子”与受者骨髓微环境“土壤”和谐共处
人类白细胞抗原 (HLA) 是免疫系统的重要组成部分,供受者HLA不全相合会阻碍干细胞“种子”在受者骨髓微环境的“土壤”里成长发育。“北京方案”和“巴尔的摩方案”等单倍型移植新方案在临床实践中部分克服了HLA屏障,显著改善了患者生存状况,极大促进了异基因造血干细胞移植的发展,迎来了“人人有供者”的新时代。
2022年一系列研究进一步加深了我们对免疫屏障的理解。粒细胞集落刺激因子 (G-CSF) 和细胞因子信号转导抑制因子1 (SOCS1) 信号通路,及其对T和NK(Natural Killer)细胞作用的发现,以及G-CSF动员前后的单细胞测序研究,进一步证明G-CSF诱导免疫耐受,是克服HLA屏障的关键机制。
造血干细胞“种子”在新的骨髓微环境中“植入不良”会严重影响移植疗效。2022年针对影响植入的关键调控靶点(如巨噬细胞,骨髓血管内皮细胞)的研究进展有望为防治植入不良提供更好的方案。乙酰半胱氨酸既是一种化痰药,也是抗氧化剂,通过体外研究发现能有效清除活性氧,改善骨髓微环境,随后通过前瞻随机对照研究证实能够有效降低移植后植入不良的发生率,实现从基础到临床的转化,成为通过价廉、低毒的老药解决移植后重大临床难题的经典案例。
更安全有效治疗移植物抗宿主病,破解“成长的烦恼”
移植物抗白血病效应是移植后清除残存肿瘤细胞的关键,但其带来的移植物抗宿主病 (GvHD)则是难以避免的“成长的烦恼”,其中的关键是如何有效治疗激素耐药GvHD。
巴利昔单抗是一种人鼠嵌合单克隆抗体,通过阻断 IL-2受体抑制激活的T细胞,从而治疗GvHD。我国研究团队通过迄今为止规模最大的巴利昔单抗治疗激素耐药急性GvHD患者的真实世界研究证明了其有效性和安全性,并通过机器学习首先确定了巴利昔单抗治疗的最优方案。随后III期随机对照研究证实,间充质干细胞联合巴利昔单抗和钙调磷酸酶抑制剂或许可以进一步改善激素耐药急性GvHD的疗效。
芦可替尼是一种Janus激酶抑制剂,通过抑制多种免疫细胞和炎症因子治疗GvHD。在全球多中心III期随机对照研究(REACH 3)中,芦可替尼治疗激素耐药慢性GvHD表现出了较对照组更好的疗效,且最新的荟萃分析也证实了芦可替尼对儿童和成人患者均具有效性和安全性。
此外,2022年还有许多新药及微生物制剂(如Belumosudil、MaaT013)也已取得关键进展,并在临床研究中崭露头角,在未来可能成为治疗激素耐药GvHD的重要新力量。
强强联手,“细胞治疗护卫队”携手造血干细胞移植实现更佳疗效
2022年,以嵌合抗原受体T细胞(CAR-T)为代表的细胞治疗获得了蓬勃发展,通过与造血干细胞移植 “强强联合”,进一步提高了疗效及安全性。
难治/复发(R/R)白血病预后极差,CAR-T治疗缓解率高,但长期生存表现差强人意,大部分患者通过造血干细胞移植才能获得长期生存。因此CAR-T治疗桥接造血干细胞移植成为R/R急性B淋巴细胞白血病患者的标准治疗方案,而针对急性T淋巴细胞白血病CD7靶点的CAR-T在2022年大放异彩,使更多患者受益于“移植+CAR-T”治疗。
移植后的细胞治疗也取得系列进展,例如CAR-T治疗有助安全有效地清除移植后的微小残留病 (MRD);输注供者来源的多种白血病抗原特异性T细胞 (mLST) 可以预防移植后复发;输注巨细胞病毒 (CMV) 特异性细胞毒性T淋巴细胞 (CMV-CTLs)有助重建内源性CMV特异性细胞免疫,有效防控移植后CMV的激活。
总结与展望
通过促进干细胞和骨髓微环境的和谐共处,促进干细胞稳定植入及重建造血,通过不同靶点治疗耐药GvHD,与多种细胞疗法强强联合,进一步改善移植疗效和安全性,“人人有供者”的新型造血干细胞平台将发挥更强大的治愈能力,惠及全球患者。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。