Nat Genet:血浆代谢组基因组图谱突出代谢物与人类疾病的联系
代谢过程与疾病风险相关,代谢物作为代谢反应中间或末端产物,其水平受多种因素影响,包括遗传学、生活习惯、肠道微生物、疾病等【1-3】,代谢物能够左右疾病风险并能作为治疗干预的靶点【4】。许多代谢物的遗传可能性都很高,我们能够通过孟德尔随机性(Mendelian randomization, MR)来进行遗传操作,从而检测代谢物在疾病中的作用【5】。以往全基因组关联研究(GWASs),全基因组测序和全外显子测序都揭示了代谢物水平的遗传架构,但测序研究往往受限于样本大小或代谢物数目,因此囊括更多代谢物更多遗传因素的大规模研究十分必要。
2023年1月12日,来自加拿大戴维斯夫人医学研究所的J. Brent Richards团队在Nature Genetics上发表了题为Genomic atlas of the plasma metabolome prioritizes metabolites implicated in human diseases的文章,作者对1,091个血液代谢物和309个代谢比率进行了基因组关联分析,分别识别了248个位点,690种代谢物和69个位点,143个代谢比率的关联。整合代谢物——基因和基因表达信息,作者识别了109种代谢物和48个代谢比率的94个效应基因,进一步地,作者识别了与12种性状和疾病存在因果关系的22种代谢物和20个代谢比率。研究描述了代谢物的遗传结构,为研究代谢物在基础疾病中的作用提供了宝贵资源,也为治疗靶点的寻找提供线索。

在测试的1,091种血浆代谢物中,850个已知参与脂质、氨基酸、核酸等8种超途径(superpathway),剩下241种属于未被完善描述的小分子,此次研究也囊括了81种之前代表性的大规模代谢GWASs中未提及的代谢物。除异源代谢物和碳水化合物外,每种超途径中,超过50%测试的代谢物都有独立的突变——代谢关联。作者识别了690种代谢物中1,702个独立的变异——代谢关联,并将其与4个资源数据库和最近的两个代谢GWASs作比较,发现771个与之前报道显著相关,另外257个具有显著性的关联则被认为是新发现的,而在共享的变异——代谢关联中,90%对应的代谢物都有相同方向的效应。这种遗传学关联能够通过SNP,多遗传性和基因多效性表征,如关联位点数与代谢物可遗传性正相关。
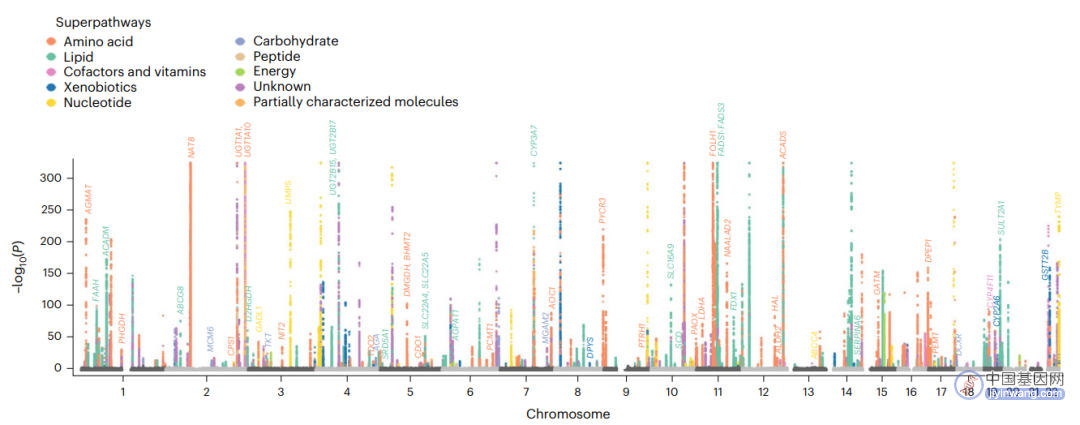
图1 代谢物水平与遗传位点间的关联
由于很多代谢物通常是酶反应的产物和底物,衡量代谢比率的遗传决定因素通常能够提供更多与生物学有关的信息。作者计算了共享酶及转运子的代谢比率,与现有方法相比,此种策略展现出了更强大的统计效益及生物学可行性。在GWAS的309种代谢比率中,作者鉴定了69个位点,143个代谢比率的247种关联,其中242种没有被报道过,63个位点代谢比率关联是新发现的。此外,作者还鉴定出了16个基因组范围的显著遗传变异,提示代谢形成比率能够帮助鉴定新的遗传决定子。随后,作者鉴定了相关代谢物参与的超途径,大部分是氨基酸和脂质,能量相关的超途径会与其他多种代谢物相关。
接下来,作者开始寻找控制代谢物及其比例的有关基因以用于治疗干涉。利用基于基因表达的eQTL或sQTL数据和基于生物学基础认知的4种数据库,作者分别鉴定了625个突变的545表达相关基因和321个突变的262个生物学相关基因。他们比较了两种方法中优先选择的基因,得到了189个突变代谢关联的94个效应基因,其中超过90%都编码酶或转运子。作者整合代谢疾病关联和药理学信息,发现94个效应基因中42个基因编码的蛋白能够以拮抗,底物,抑制子或诱导子的方式参与发育的不同阶段,67个基因与孟德尔疾病有关,其中14个已在小鼠中被描述,可成为潜在药物靶点。
那么新发现的基因——代谢关联实用性如何呢?作者在双样本MR中进行了应用,采用12种主要受年龄、代谢和免疫应答的代表性性状及疾病。他们筛选了171种与已知效应基因相关的突变——代谢关联及比率关联,鉴定出了33个代谢结果对和30个比例结果对。在BMI相关效应中,作者鉴定出了13个代谢物,会对eBMD产生明显影响但不影响BMI。有趣的是,研究还发现乳清酸盐和骨折间存在关联,乳清酸盐与eBMD负相关,而低eBMD又与骨折风险升高正相关。
综上,文章通过了系列大规模的GWASs研究,涉及8,299位个体中1,091个代谢物和309个代谢比率,鉴定出了具有强生物学显著相关性的遗传信号,推测了12种性状和疾病相关的代谢水平和比例的效应,也发现了一个估测骨密度的首要候选代谢物。
原文链接:
https://doi.org/10.1038/s41588-022-01270-1
参考文献:
1. Bar, N. et al. A reference map of potential determinants for thehuman serum metabolome. Nature 588, 135–140 (2020).
2. Lee, W.-J. & Hase, K. Gut microbiota-generated metabolites inanimal health and disease. Nat. Chem. Biol. 10, 416–424 (2014).
3. Pietzner, M. et al. Plasma metabolites to profile pathways innoncommunicable disease multimorbidity. Nat. Med. 27,471–479 (2021).
4. Wishart, D. S. Emerging applications of metabolomics in drugdiscovery and precision medicine. Nat. Rev. Drug Discov. 15,473–484 (2016).
5. Smith, G. D. Mendelian randomization: prospects, potentials, andlimitations. Int. J. Epidemiol. 33, 30–42 (2004).
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。