罕见卵巢癌进行基因检测有什么意义?
癌症基因组图谱(TCGA)泛癌种分析揭示了主要癌症类型的分子特征,包括高级别浆液性癌(HGSCs)。然而,卵巢癌中罕见组织病理学类型的特征仍不明确。本研究旨在对罕见卵巢恶性肿瘤,包括非上皮性肿瘤(NETs,包括生殖细胞肿瘤和性索肿瘤)和透明细胞癌(CCC)进行分子特征分析,比较其与HGSCs的不同。根据组织病理学类型,对2014年1月至2019年3月期间在静冈癌症中心接受手术切除的69例卵巢恶性肿瘤进行了分类。这些肿瘤患者(包括NETs)进行了胚系和体细胞突变NGS检测。CCC具有对化疗耐药的特征,基于基因表达分析探索了耐药相关主要通路。NETs携带拷贝数中性杂合性缺失(cnLOH),同源重组缺陷(HRD)评分较高,2例NET患者检出PALB2和BARD1胚系突变。在化疗耐药CCC中,上皮-间充质转化(EMT)通路激活,无论ABC转运蛋白基因表达情况如何。
研究背景
在所有妇科肿瘤中,晚期卵巢癌预后较差,超过80%的患者在标准治疗后复发。最佳减瘤手术和化疗是晚期卵巢癌的主要治疗方法。尽管化疗对浆液性癌有效,但大多数患者复发且难以治愈。二十多年来,铂类化疗一直是关键方案,没有其他疗法更有效。近年来,随着聚(ADP-核糖)聚合酶(PARP)抑制剂的出现,卵巢癌治疗经历了快速变化,研究显示,这类药物对BRCA1/2基因胚系或体细胞突变和/或同源重组缺陷(HRD)的患者比较有效。癌症基因组图谱(TCGA)项目基于分子谱,揭示了卵巢浆液性癌中BRCA1/2突变和/或HRD患者的分布。根据TCGA,51%的患者携带同源重组修复相关基因变异,包括BRCA1/2基因变异(33%)。因此,卵巢浆液性癌患者可能从PARP抑制剂治疗中获益。
大约90%的卵巢恶性肿瘤是上皮性肿瘤,而几种罕见的肿瘤,包括生殖细胞肿瘤和性索肿瘤,被归类为非上皮性肿瘤(NETs)。最近,突变分析发现,生殖细胞肿瘤突变率低,携带PIK3CA扩增。然而,在NETs中,对与PARP抑制剂疗效相关的BRCA1/2胚系突变和HRD状态了解较少。
在欧洲和美国,透明细胞癌(CCC)较为罕见,约占所有卵巢癌的10%。在日本,20%-25%的卵巢癌被归类为CCC,是主要的组织学类型之一。相比其他组织学类型的卵巢恶性肿瘤,CCC化疗耐药更常见。有研究对CCC进行了NGS检测,分析了其分子谱。然而,介导CCC耐药的通路仍不清楚。
本研究重点是这类罕见卵巢癌。本研究纳入了接受了NGS基因检测的日本卵巢癌患者。分析了上皮性肿瘤(包括卵巢浆液性癌和CCCs)和NETs与化疗耐药相关的特征以及与PARP抑制剂疗效相关的BRCA1/2突变和HRD状态特征。本研究旨在为卵巢浆液性癌以外的罕见卵巢癌组织学类型的治疗提供新的信息。
研究结果
卵巢恶性肿瘤样本分布
在我们先前的研究Project HOPE中,癌症患者进行了WES和靶向panel测序。本研究筛选了HOPE队列(包括5521例肿瘤样本)中79例具有详细临床信息的卵巢肿瘤样本。由于本研究重点关注恶性卵巢肿瘤,因此排除了良性(n = 10)肿瘤。恶性肿瘤(n = 69)包括20例CCCs,17例高级别浆液性癌(HGSCs),12例子宫内膜样癌(ECs),5例NETs(2例未成熟畸胎瘤,1例卵黄囊瘤,1例混合性生殖细胞肿瘤,1例幼年型颗粒细胞瘤),4例黏液性癌,4例交界性肿瘤(2例浆液黏液性,2例黏液性)和7例其他(图1)。所有恶性肿瘤患者的临床特征见表1。
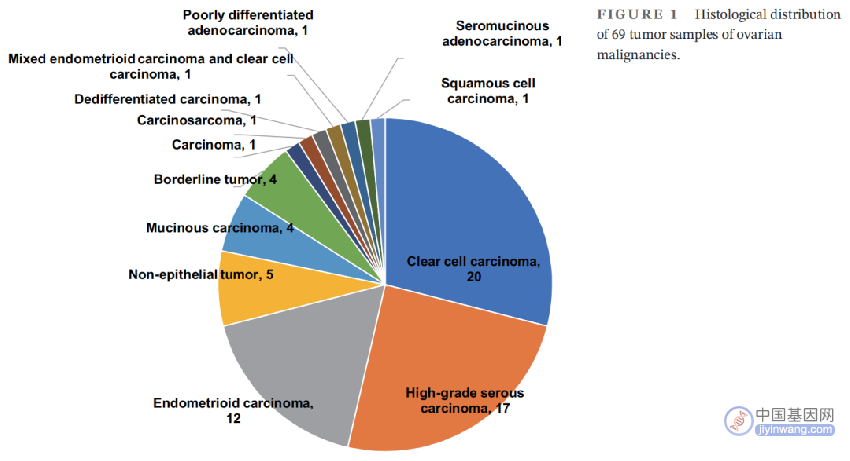
图1. 69例卵巢恶性肿瘤样本的组织学分布
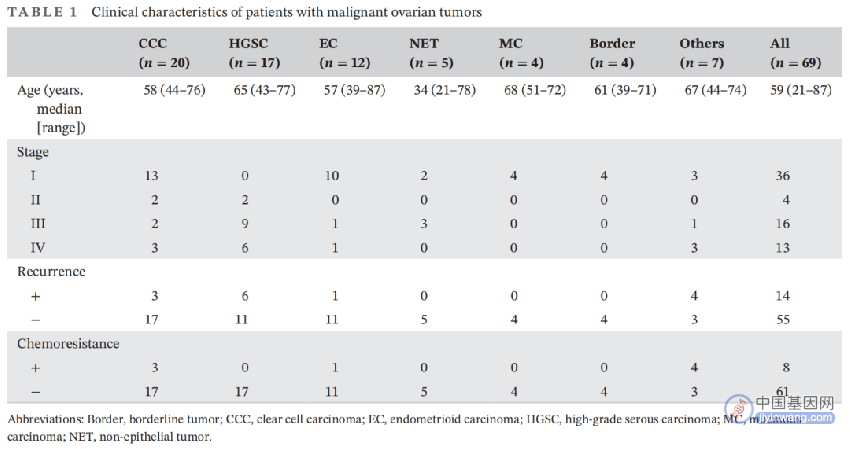
表1. 卵巢恶性肿瘤患者的临床特征
卵巢恶性肿瘤突变谱
为了探索日本卵巢恶性肿瘤患者的突变谱,使用了全外显子组测序(WES),靶向panel测序,已知融合基因测序和基因表达谱(GEP)。图2展示了根据组织病理学分类的样本的突变谱。HGSCs的HRD评分高于其他组织病理学样本。在HGSC样本中检出TP53(88%,15/17)突变。在CCC中检出PIK3CA(55%,11/20)和ARID1A(60%,12/20)突变。在EC中检出PIK3CA(58%,7/12)和KRAS(50%,6/12)突变。这些体细胞突变检出情况与先前的研究一致。T细胞炎性GEP可以预测免疫检查点抑制剂(ICIs)疗效,在卵巢癌中高表达,特别是在HGSC中,尽管TMB<10个突变/ Mb。最近的一项研究显示,在88%(15/17)的HGSC中发现了SBS39。在CCC中,识别了FOXA2突变(20%,4/20)。NETs是罕见的卵巢恶性肿瘤,有趣的是,在NETs中,发现了PALB2和BARD1胚系突变以及高HRD评分。
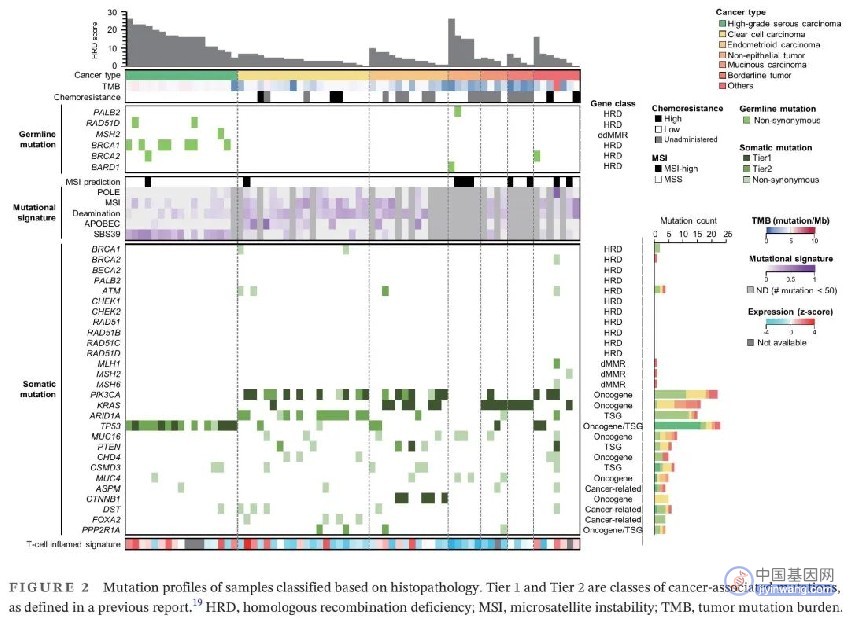
图2. 根据组织病理学分类的样本突变谱
接下来,对CNV进行分析,研究卵巢恶性肿瘤中的染色体变异(图3)。分别在36%–39%、34%–46%和38%–46%的样本中观察到 1q31.1-1q31.3、3q24-3q26.33和8q12.1-8q24.23扩增。HGSCs扩增检出率最高(76%,13/17),其次是CCCs(60%,12/20)和ECs(58%,7/12)。在NETs中发现了拷贝数中性杂合性缺失(cnLOH),包括未成熟畸胎瘤2例,卵黄囊瘤1例。各亚组间其他染色体增加和缺失无显著差异。
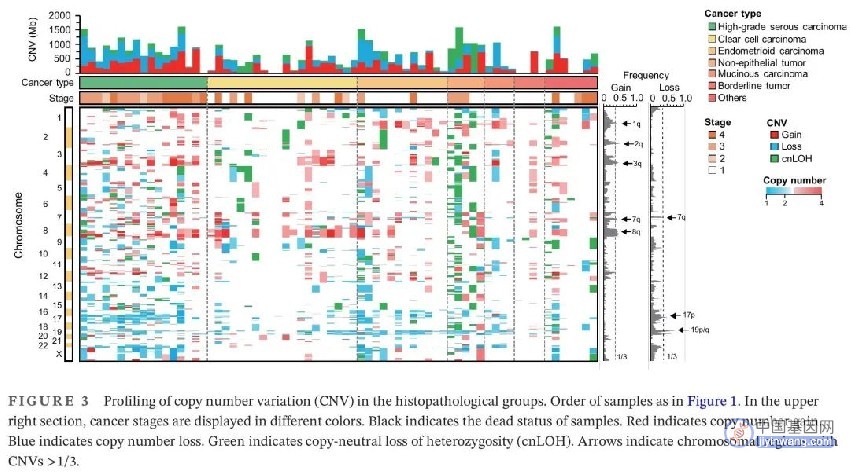
图3. 各组织病理学亚型的拷贝数变异(CNV)情况
卵巢恶性肿瘤通路分析
化疗是晚期卵巢恶性肿瘤的主要治疗手段之一。化疗对大多数卵巢肿瘤有效,如HGSCs,但对某些组织学类型疗效不佳。与其他组织学类型相比,CCCs对化疗耐药的情况更常见。为了研究CCCs耐药相关生物学通路,在CCCs中,对化疗耐药组(n = 3)和非化疗耐药组(n = 17)进行了基因集富集分析(GSEA)。在化疗耐药组中,与上皮-间充质转化(EMT)相关的基因集显著富集(表2)。为了确定与细胞毒性药物外排相关的基因表达差异,基于GEP分析了膜蛋白(包括ABC转运蛋白)基因表达水平。HNF1B和ANXA4在所有CCCs中均高表达,在化疗耐药组和非化疗耐药组之间未观察到膜蛋白基因表达情况存在显著差异。
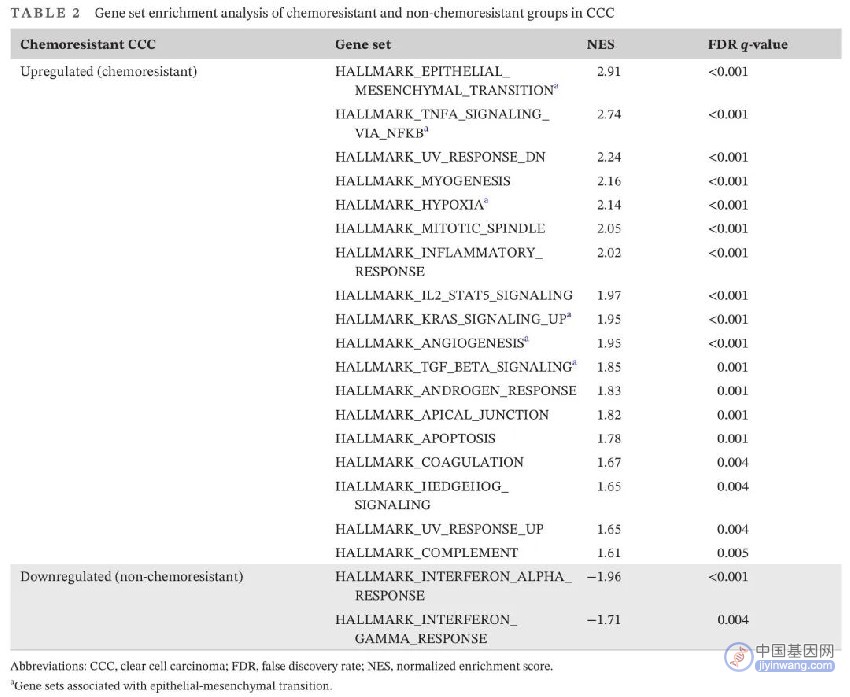
表2. CCC中化疗耐药组和非化疗耐药组基因集富集分析
讨 论
大约90%的卵巢恶性肿瘤为上皮性肿瘤,而在其余10%中,非上皮性肿瘤占大多数。生殖细胞肿瘤和性索间质瘤较为罕见,主要由非上皮性成分组成。尽管这些肿瘤组织病理学类型不同,但本研究将其归为NETs。NETs的组织学和临床特征与上皮性肿瘤不同,提示NETs具有不同的分子特征。组织病理学类型的不同可能对分析结果有影响。因此,未来研究需要纳入更多NET患者。
与HGSCs相似,这些肿瘤的HRD评分较高,而PARP抑制剂对HRD评分高的肿瘤有效。在未成熟畸胎瘤(归类为生殖细胞肿瘤)中检出PALB2(c.3350 + 5G>A,剪接区域)和BARD1(p.Q206fs)胚系截短突变,HRD评分很高。BARD1与BRCA1形成复合体,参与DNA修复。PALB2是与BRCA2相互作用的蛋白,通过同源重组(HR)在DNA修复中起作用。上述突变可能导致HR缺陷,使得HRD评分高。HRD评分高的NETs不携带可见于HGSC的BRCA1和BRCA2突变,然而,仍可能获益于PARP抑制剂治疗。
染色体CNV分析显示,在HRD评分较高的未成熟畸胎瘤和卵黄囊瘤(归类为生殖细胞肿瘤)的广泛染色体区域发现cnLOH,而在HGSC中较少见。在白血病患者中,cnLOH与DNA双链断裂修复异常相关。卵巢来源的未成熟畸胎瘤研究报告了可诱导cnLOH的减数分裂异常。这些发现提示HRD与cnLOH的相关性,与HGSCs中的染色体不稳定性不同,生殖细胞肿瘤中HR介导的不完全DNA修复可能优先导致cnLOH。
在多个癌种中,TMB被用作ICIs疗效预测生物标志物。一些卵巢癌对ICIs有反应。大规模研究表明,T细胞炎性GEP可以预测对ICIs的反应。T细胞炎性GEP在HGSC中高表达,无论TMB如何。因此,ICIs可能对HGSC有效。
在日本,CCC占卵巢癌的20%-25%,是主要的组织学类型之一。尽管CCC是最常见的对化疗耐药的癌症之一,但潜在耐药机制尚不明确。我们对CCC化疗耐药和非耐药组的比较分析表明,在耐药组中,EMT相关通路基因表达上调,无论ABC转运蛋白家族基因表达情况如何。EMT通路的激活引起肺癌和胰腺癌的耐药性。此外,研究显示,在卵巢CCC中,EMT通路基因高表达与预后不良相关。本研究中,化疗难治性卵巢CCC患者EMT通路基因高表达,提示该通路在化疗耐药中起着关键作用。
本研究对罕见卵巢癌进行了分析,揭示了NETs和卵巢CCC的特征。然而,样本量较小,不足以有统计学意义。未来需要对大量患者进行进一步分析,来验证本研究结果。本研究重点关注罕见组织学类型的卵巢癌。虽然生殖细胞肿瘤是NETs,但与HGSCs相似,HRD评分较高。我们发现BARD1和PALB2胚系突变与HR和cnLOH累积相关。此外,在化疗耐药CCC中,EMT通路基因表达上调。卵巢恶性肿瘤的横断面分子特征分析可能有助于未来对这类罕见卵巢肿瘤的研究。
参考文献:
Takahashi N, Hatakeyama K, Nagashima T, Ohshima K, Urakami K, Yamaguchi K, Hirashima Y. Characterization of rare histological subtypes of ovarian cancer based on molecular profiling. Cancer Med. 2023 Jan;12(1):387-395. doi: 10.1002/cam4.4927. Epub 2022 Jun 8. PMID: 35676859; PMCID: PMC9844652.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。