陈正一团队首次通过AAV基因治疗恢复遗传性耳聋老年小鼠听力

听力损失(Hearing Loss)是最常见的感觉缺陷障碍之一,影响着全世界超过5%的人口(约4.66亿人),其中3400万是儿童。听力损失还与社会孤立的增加以及患痴呆症和抑郁症的风险增加有关。
预计到2050年,每10个人中就有1个人会受到听力损失的折磨,听力损失造成了社会和情感上的缺失,并在全球范围内造成了日益严重的经济负担。虽然助听器和人工耳蜗能够提供一定程度的缓解,但目前还没有可用的治疗方法可以逆转或预防遗传性听力损失。这促使科学家们尝试开发基于基因治疗的听力损失解决方案。
腺相关病毒(AAV)是一类具有低免疫原性和高安全性的基因治疗递送载体,也是目前最广泛研究和应用的体内基因治疗递送载体,FDA此前已批准两款AAV基因疗法,分别用于治疗先天性黑蒙症和脊髓性肌萎缩症(SMA)。内耳作为一个相对孤立的器官,可以进行局部注射,从而实现安全的基因治疗。
2023年5月26日,哈佛大学医学院陈正一团队在 Molecular Therapy 期刊发表了题为:Rescue of auditory function by a single administration of AAV TMPRSS3 gene therapy in aged mice of human recessive deafness DFNB8 的研究论文。
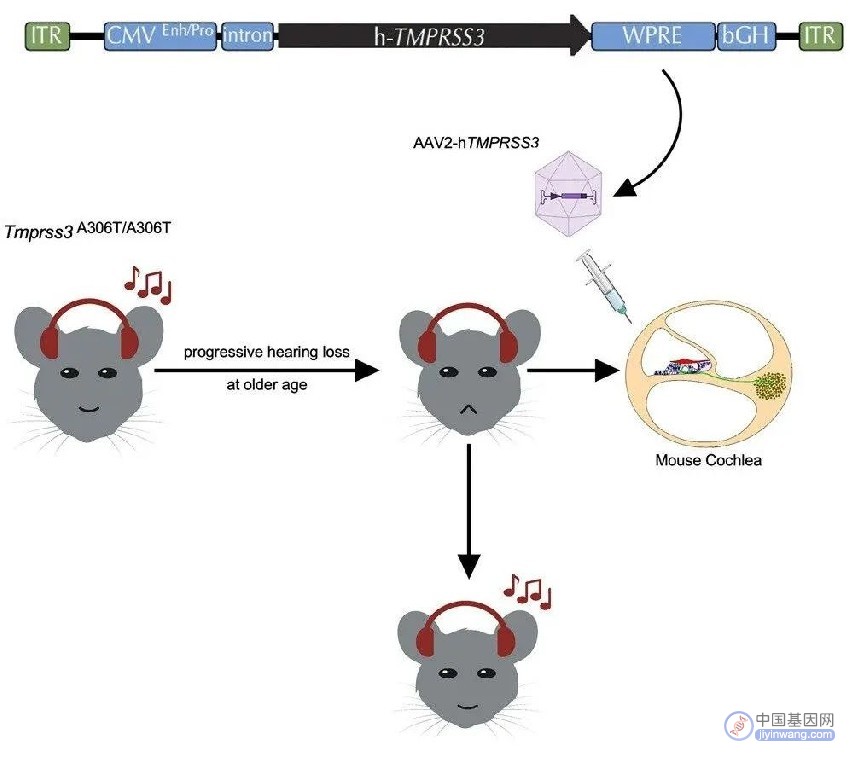
该研究构建了模拟人类TMPRSS3基因突变的语后进行性耳聋(DFNB8)小鼠模型,并通过AAV2向该老年小鼠模型内耳递送正确的TMPRSS3基因,成功恢复其听力损失,这也是首次证明AAV基因治疗在听力损失老年动物模型中的有效性。

尽管已有多项研究通过AAV基因治疗挽救了遗传性听力损失的新生动物的听力,但尚未在发育成熟或老年动物模型中验证这种治疗能力。由于人类出生时耳朵发育完全,因此在对遗传性听力损失患者进行干预试验之前,有必要进行概念验证。
在这项最新研究中,陈正一团队首次证明了AAV基因治疗在听力损失老年动物模型中的有效性。
TMPRSS3基因突变是一种常见的遗传性听力损失的致病原因,TMPRSS3基因突变个体中存在两种不同类型的常染色体隐性遗传性听力损失——先天性重度/极重度耳聋(DFNB10)和语后进行性耳聋(DFNB8)。前者出生时即已耳聋,后者在10-12岁开始逐渐丧失听力。
为了构建适合基因治疗干预的TMPRSS3突变小鼠模型,研究团队构建了具有人类TMPRSS3基因突变(c.916G>A, Ala306→Thr)的基因敲入DFNB8小鼠模型,该突变会导致小鼠成年发病和进行性听力损失。
研究团队观察到,向上述老年小鼠模型的内耳注射携带健康人类TMPRSS3基因的腺相关病毒2型(AAV2)后,TMPRSS3基因在内耳毛细胞和蜗轴区域重新表达。老年小鼠的听力得到了强有力的恢复,并伴有毛细胞(HC)和耳蜗螺旋神经节细胞(SGN)的存活。
论文通讯作者陈正一教授表示,这项研究结果表明,病毒介导的基因疗法,无论是单独使用还是与人工耳蜗联合使用,都有可能治疗遗传性听力损失。这也是第一个挽救老年小鼠听力的研究,表明了通过AAV基因治疗老年DFNB8患者是可行的。
论文链接:https://doi.org/10.1016/j.ymthe.2023.05.005
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。