非小细胞肺癌6大融合基因检测8大强烈推荐
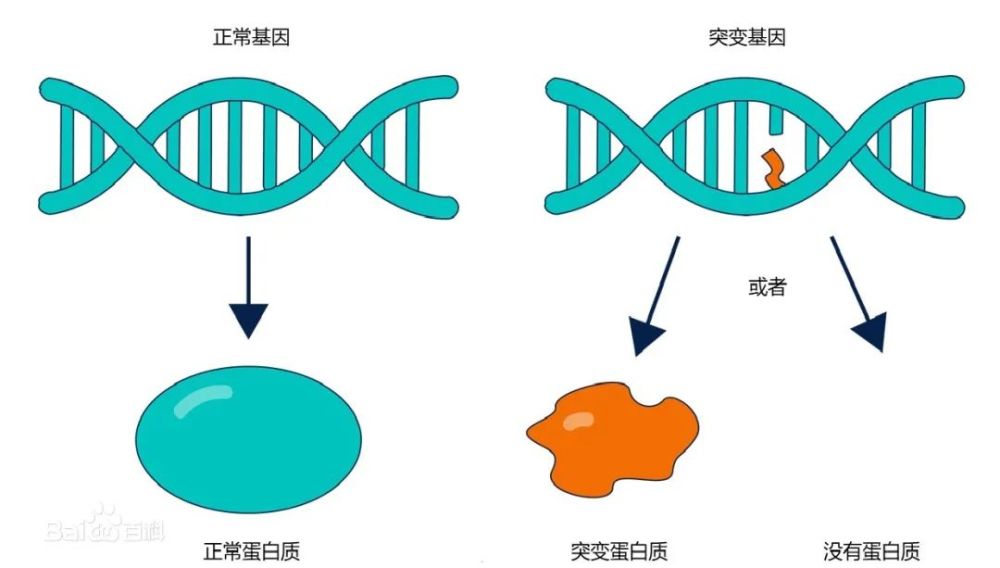
1、融合基因是指两个不同基因的部分或全部序列相连形成的新的混合基因,其编码产生的融合蛋白能够介导肿瘤的发生发展。
2、融合基因阳性NSCLC患者占所有NSCLC患者的8%-12%。
3、基于靶向药物的可及性,融合基因分为必检基因与扩展基因两类。
必检基因:间变性淋巴瘤激酶(ALK)、c-ros原癌基因1(ROS1)、转染重排原癌基因(RET)和神经营养因子受体酪氨酸激酶(NTRK);
扩展基因:神经调节蛋白(NRG)、成纤维细胞生长因子受体(FGFR)、间质表皮转化因子(MET)、表皮生长因子受体(EGFR)、人类表皮生长因子受体2(HER2)和鼠类肉瘤滤过性毒菌致癌同源体B1(BRAF)等。
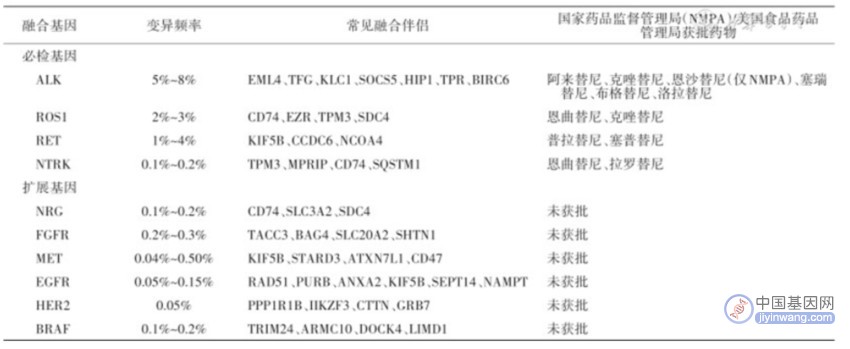
非小细胞肺癌中主要的融合基因及获批药物
推荐意见1:推荐病理学诊断为肺腺癌(包括含腺癌成分)的晚期初治NSCLC患者及靶向药物治疗后耐药的NSCLC患者进行融合基因检测(强烈推荐);建议经活检组织病理学诊断为非腺癌的晚期NSCLC患者及术后明确为浸润性腺癌的Ⅱ-Ⅲ期NSCLC患者进行融合基因检测(推荐)。
4、NSCLC患者进行融合基因检测时应首选肿瘤组织学标本,无法获取足够组织学标本时可选用细胞学标本,组织学或细胞学标本应由专业的病理医师进行肿瘤细胞含量评估(包括肿瘤细胞比例及数量)。
5、若组织学和细胞学标本均不可及或无法满足检测需求,可选用液体活检标本(血液、浆膜腔积液、脑脊液等的上清液)。但液体活检用于融合基因检测具有较高的假阴性率。
推荐意见2:推荐首选肿瘤组织学标本进行融合基因检测,无法获取足够肿瘤组织学标本时,可选择细胞学标本。在检测融合基因前,由专业的病理医师对组织或细胞学标本进行肿瘤细胞含量评估(强烈推荐);无法获取足够肿瘤组织学或细胞学标本时,建议选择液体活检作为补充检测手段(推荐)。
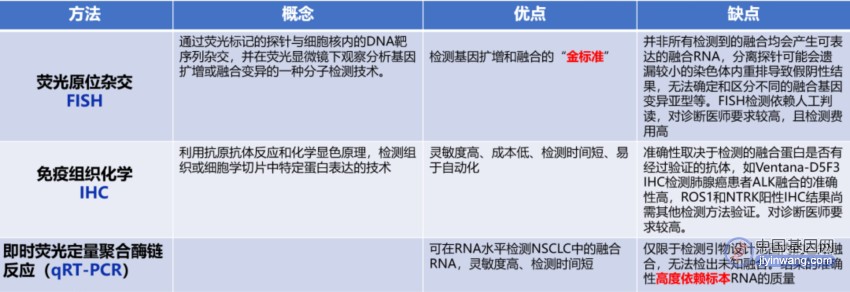
6、目前常用的融合基因检测方法包括荧光原位杂交(FISH)、免疫组织化学(IHC)、即时荧光定量聚合酶链反应(qRT-PCR)和二代测序等。
融合基因检测的常用方法
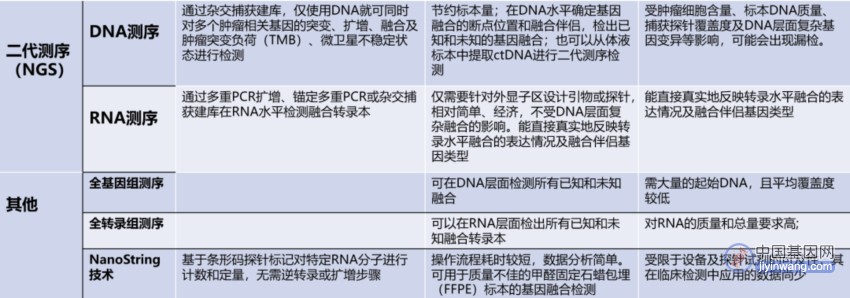
推荐意见3:应根据送检标本类型、肿瘤细胞含量、标本质量、所检融合基因特点、平台可及性、检测周期及费用等因素,合理选择检测平台及方式,必要时可多平台互补和验证(强烈推荐)。
7、基因融合主要通过染色体结构重排形成,常见的染色体重排发生机制包括倒置、易位、插入、缺失、串联重复、染色体碎裂等,从而在DNA层面形成基因融合。根据5′和3′端基因断点在基因组的位置不同,基因融合可分为基因内融合、基因间融合和混合性融合。
基因融合分类

推荐意见4:DNA层面检出的罕见融合伴侣、外显子断点融合及基因间融合应在RNA或蛋白水平进一步验证(强烈推荐)。
ALK融合
8、ALK融合已发现多种融合伴侣,最常见的EML4-ALK融合已有20多种变体亚型,其中60%以上的EML4-ALK融合亚型为变体1(EML4第13号外显子与ALK第20号外显子融合)和变体3(EML4第6号外显子与ALK第20号外显子融合),不同EML4-ALK亚型的患者TKI治疗的疗效可能会存在差异。
9、ALK融合检测推荐使用Ventana-D5F3 IHC、FISH、qRT-PCR和二代测序方法.
10、Ventana-D5F3抗体IHC在肺腺癌患者中的灵敏度和特异度高,但该检测用于低分化癌、神经内分泌癌和鳞状细胞癌时可能出现非特异性着色,疑似阳性结果需要通过其他方法验证。
11、ALK选择性转录起始(alternative transcription initiation)可导致ALK IHC阳性表达,且此类患者能够从ALK TKI中获益,但目前常用的DNA和RNA层面的检测技术多无法准确检出ALK选择性转录起始,需要经过优化的二代测序或NanoString才能明确。
ROS-1融合
12、ROS1最常见融合伴侣为CD74和EZR,融合断点最常发生在ROS1基因第30~34号内含子。
13、ROS1融合推荐使用FISH、qRT-PCR和二代测序检测,IHC检测仅用于初筛,阳性结果需其他方法验证。FISH是ROS1融合检测的“金标准”。
14、FISH易漏检GOPC-ROS1融合。原因:GOPC与ROS1基因均位于第6号染色体,两者位置接近,当通过缺失产生GOPC-ROS1融合时,红绿分离探针信号并不会发生改变。
15、DNA二代测序检测易漏检ROS1融合,原因:
①ROS1融合常见断点位置的内含子区较大;
②常见断点位置鸟嘌呤和胞嘧啶(GC)含量低,导致探针捕获效率低;
③常见断点位置存在高度腺嘌呤和胸腺嘧啶(AT)重复区等多样性较低的区域,影响后续数据比对分析的准确性。
RET融合
16、RET融合伴侣在NSCLC中以KIF5B最为常见。最常见的融合断点位于第11号内含子,因此其3′端保留了酪氨酸激酶域(第12-19号外显子)。
17、RET融合推荐使用FISH、qRT-PCR和二代测序检测。IHC检测RET融合的灵敏度和特异度不高,目前不做推荐。
18、FISH检测NCOA4-RET的灵敏度较低,可能与NCOA4和RET两基因在DNA层面距离过近有关。
NTRK融合
19、NTRK融合常见于特定的恶性肿瘤(如婴幼儿纤维肉瘤和乳腺分泌性癌),在NSCLC患者中相对少见(<1%)。
20、NTRK基因包括NTRK1、NTRK2和NTRK3(分别编码TrkA、TrkB和TrkC蛋白)3种亚型,3种NTRK基因高度同源,激酶域均位于第13-18号外显子区域。
21、NTRK融合断点多位于第8-13号内含子区域,使其3′端保留了NTRK激酶域。在NSCLC患者中,以NTRK1融合最为常见,TPM3是最常见的NTRK1融合伴侣。
22、NTRK融合基因推荐使用FISH、qRT-PCR和二代测序等方法检测NTRK融合。Trk蛋白在神经和平滑肌组织中有生理性表达,在结果判读时需注意。
23、基于DNA和RNA的靶向二代测序均可用于NTRK融合基因的检测,但须注意NTRK2和NTRK3基因存在较大的内含子区,杂交捕获DNA二代测序在探针设计上很难做到完全覆盖,目前对其检测策略多为针对其融合伴侣设计探针进行检测,因此只能检测常见的NTRK2/3融合,罕见融合可能会漏检。
推荐意见6:对于必检融合基因,推荐使用二代测序或qRT-PCR进行检测(强烈推荐),建议使用FISH进行检测(推荐)。
推荐意见7:推荐使用IHC检测ALK融合(强烈推荐),建议IHC仅用于ROS1和NTRK融合初筛,阳性结果需其他平台验证(推荐);不建议IHC用于RET融合检测(推荐)。
NRG融合
24、NRG1融合在NSCLC患者中罕见,最常见的融合伴侣为CD74。其有3种亚型(Ⅰ-Ⅲ型),不同亚型在NRG1的5′端存在一个特异的外显子。
25、NRG1融合断点常位于:
①Ⅰ型外显子和第2号外显子间47 kb(千碱基对)的内含子区;
②Ⅱ型外显子和第2号外显子间955 kb的内含子区;
③第5号和第6号外显子间包含了Ⅲ型外显子的区域(111 kb)。
26、NRG2融合更为罕见。基于DNA和RNA的靶向二代测序均可用于NRG1/2融合基因的检测,由于NRG1/2的内含子区域较大,DNA二代测序探针难以完全覆盖,易造成漏检。
FGFR融合
27、FGFR融合主要包括FGFR1、FGFR2、FGFR3和FGFR4融合,融合方式可分为Ⅰ型和Ⅱ型。
28、Ⅰ型融合为3′FGFR融合,融合蛋白中不包含FGFR的细胞外和跨膜结构域,仅包含与5′融合伴侣相连的激酶结构域。
29、Ⅱ型融合为5′FGFR融合,其细胞外、跨膜和激酶结构域保持完整,这两种类型的融合蛋白均有致癌潜力。NSCLC中以Ⅱ型融合为主(占90%以上),融合断点主要位于第17-19号内含子或外显子区。
30、鉴于FGFR融合的多样性和在NSCLC患者中较罕见,推荐使用基于DNA或RNA的二代测序进行检测。
推荐意见8:建议使用二代测序检测扩展融合基因(推荐)。
推荐意见9:基于靶点基因变异全面检测的必要性及平台的适用性,晚期初治NSCLC患者应通过二代测序或qRT-PCR进行包括融合基因在内的多基因检测(强烈推荐)。
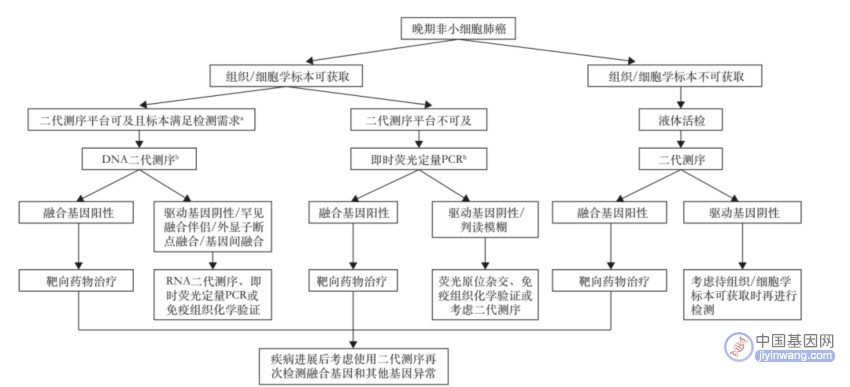
晚期初治非小细胞肺癌融合基因检测临床推荐路径
推荐意见10:靶向治疗耐药后再次活检的患者建议使用二代测序同时检测多种基因变异(推荐)。
推荐意见11:术后诊断为浸润性腺癌的Ⅱ-Ⅲ期NSCLC患者建议通过IHC检测ALK融合,或通过qRT-PCR或二代测序进行多基因检测(推荐)。
推荐意见12:如果不同检测平台的检测结果不一致,推荐用第3种平台进行验证(强烈推荐)。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。