定制寿命,源头抗衰:筛选百余种促衰基因,从头到脚治疗老年病
2019年末,南方科技大学副教授贺建奎因“基因编辑双胞胎婴儿”事件获刑三年,如今距离这对双胞胎出生已过去5年。
不久前贺建奎在牛津大学会议上发表演讲时表示,两个孩子健康状况良好,希望大家不要过度关注,并且会在她们成年后,经过本人同意后,再决定是否进行后续医疗随访。
贺建奎当时使用的基因编辑技术叫做CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats),它被称为“上帝的剪刀”,可以用于精确地切割DNA序列。
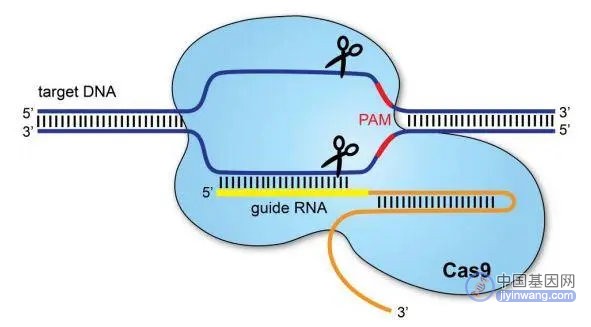
图注:CRISPER-CAS9技术
除了作为先天遗传性疾病治疗的“魔术刀”,它在抗衰领域也有不少惊喜。
PART 01
筛选促衰基因,编辑长寿基因
CRISPER/CAS9技术主要应用方向包括全基因组筛选、基因敲除/敲入、转录激活/抑制等[1]。
既然这把刀能筛选又能敲除/敲入基因,是不是意味着,先定位筛选衰老相关基因,再直接剪切就可以从源头解决衰老问题,“重焕新生”了。
筛选KAT7促衰基因
历时6年多,中科院科研团队使用CRISPR-Cas9基因编辑技术,检测了约10000个基因,最终筛选出了多达100个促进人类细胞衰老的基因[2]。
且最终确认了KAT7基因就是导致细胞衰老的罪魁祸首之一。年龄越大,KAT7基因的表达水平越高,细胞衰老也越快,可以说它是不折不扣的促衰基因。
实验结果显示,KAT7基因被编辑后的自然衰老小鼠,肝脏中衰老细胞的比例显著降低,且健康寿命大幅延长,寿命更是延长了足足25%[2]!
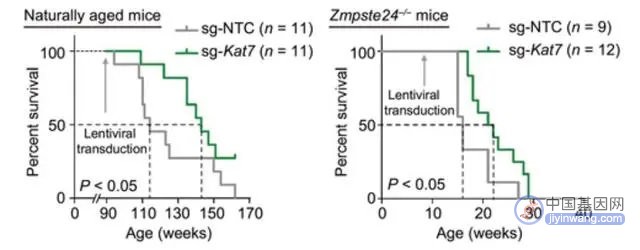
图注:针对KAT7的基因编辑延长了小鼠的健康寿命和寿命
研究人员还发现,移除KAT7同样可以延缓人类成体干细胞的衰老。
验证SIRT6长寿基因
除了通过CRISPER/CAS9技术直接筛选出促寿基因,还可以敲除某个长寿基因,来判断缺失该基因对机体的影响。
长寿蛋白SIRT6在新陈代谢和衰老中发挥重要作用[3]。来自中科院重点实验室的另一支团队基于CRISPR–Cas9技术生成了一个SIRT6缺失的食蟹猴。
结果发现,SIRT6缺陷的猴子在出生后数小时内即死亡,并表现出严重的产前发育迟缓[4]。
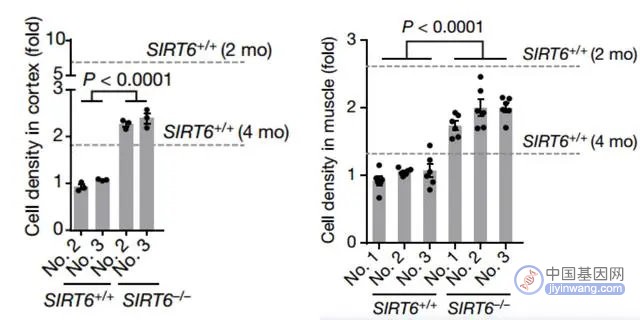
图注:SIRT6缺陷导致大脑和肌肉发育延迟
由此印证了长寿蛋白SIRT6的重要性,它参与调节非人类灵长类动物的发育,并可能提供对人类婴儿围产期(怀孕28周到产后一周)死亡综合征的机制洞察[4]。
CRISPER/CAS9可以在产生实际表型前,对衰老基因进行编辑修饰,而对于常见的老年病,已出现症状的年龄相关疾病,这把刀又该怎么下?
PART02
年龄相关疾病
下方表格展示了部分目前采用CRISPER-Cas9基因编辑技术治疗的年龄相关疾病,及它主要的优势和弊端。
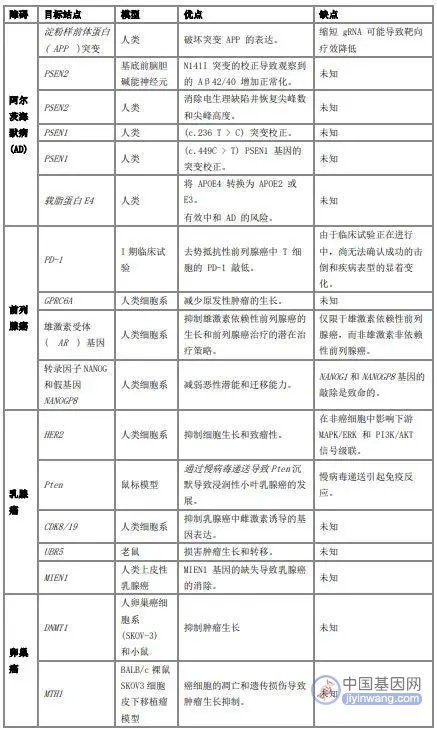
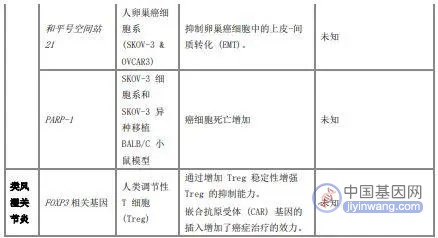
表1 CRISPR-Cas9技术在年龄相关疾病中的治疗应用[5]
CRISPER技术能从头治到脚,下面主要选择三个困扰很多老年人的年龄相关疾病,讨论通过基因编辑技术治疗这些疾病的可能性。
神经退行性疾病
CRISPR/Cas9在阿尔茨海默症研究中已得到广泛应用,从相关细胞模型构建、患病风险因素筛查到相关基因的靶标寻找和靶向治疗[6]。
2021年香港科技大学的一项研究表明,患阿尔兹海默症的小鼠在接受基因编辑技术治疗后,大脑中与神经退行病变相关的淀粉样蛋白斑块明显减少。治疗半年后(约为小鼠1/3寿命),这些淀粉样蛋白斑块,仍保持较低水平[7]。
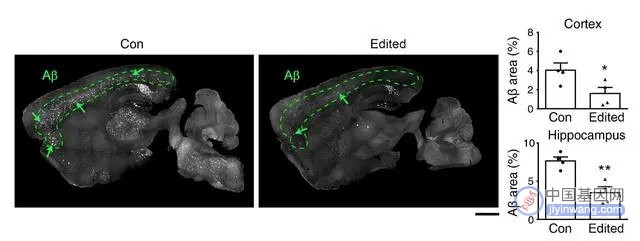
图注:基因编辑后的小鼠大脑中引起神经退行病变的淀粉样蛋白斑块减少
这证明了基因编辑技术的单次治疗可以维持长期疗效,且该研究未在小鼠身上发现任何明显的副作用。
年龄相关黄斑病变
年龄相关性黄斑变性(AMD)是老年人失明的主要原因[8],但目前主要治疗湿型 AMD 的方法仍然是眼部药物注射。
新生血管性AMD的主要病理特征是脉络膜新生血管(CNV),相关实验中,研究人员通过往成年小鼠视网膜下注射预组装的Vegfa基因特异性Cas9核糖核蛋白(RNPs),发现Cas9 RNPs有效地减少了AMD小鼠模型中脉络膜新生血管 (CNV) 的面积[8]。
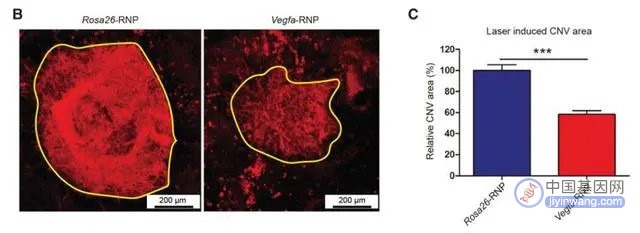
图注:注射靶向Vegfa的Cas9 RNPs可明显减少AMD小鼠模型中脉络膜新生血管(CNV)的面积
骨关节炎
2019年全球疾病负担研究(GBD)的数据显示,中国骨关节炎患者约为1.33亿,居世界首位。一项研究中,52%的85岁老人被诊断患有骨关节炎[9-11]。
美国的一项研究就探究了,CRISPER/CAS9技术通过改善与骨关节炎相关的关键分子水平,能缓解其引起的疼痛。
骨关节炎通常伴随着异常分子的上调,而研究人员通过使用CRISPER/CAS9技术,减弱了与骨关节炎相关的下游信号分子的传导,结果也显示小鼠因骨关节炎而产生的疼痛显著减少[12]。
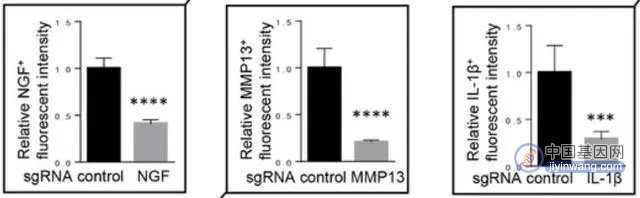
图注:CRISPR-CAS9基因编辑减弱了与骨关节炎相关的下游分子信号(NGF、IL-1β和MMP13)传导
实验结果还表明,基因编辑还能通过识别这些关键分子的表达情况,用于鉴别可行的有待开发的骨关节炎治疗靶向药物[12]。
PART 03
治疗晚期癌症,一剪刀这么简单?
癌症属于一种年龄相关的疾病,在这里单独拿出来说,是因为基因编辑技术在癌症方面的应用犹如“雨后春笋”,且多数选择该技术治疗的原因在于,其他疗法如化疗、放疗对相应癌症无效。
癌症与衰老密切相关,是老年人死亡的第二大原因[13-14]。
尽管没有文献明确指出衰老与癌症的直接相关关系,但它们有多种重叠的“元标志”。衰老的几大标识,如基因组不稳定、表观遗传改变、慢性炎症与特定的癌症标志非常相似[14]。
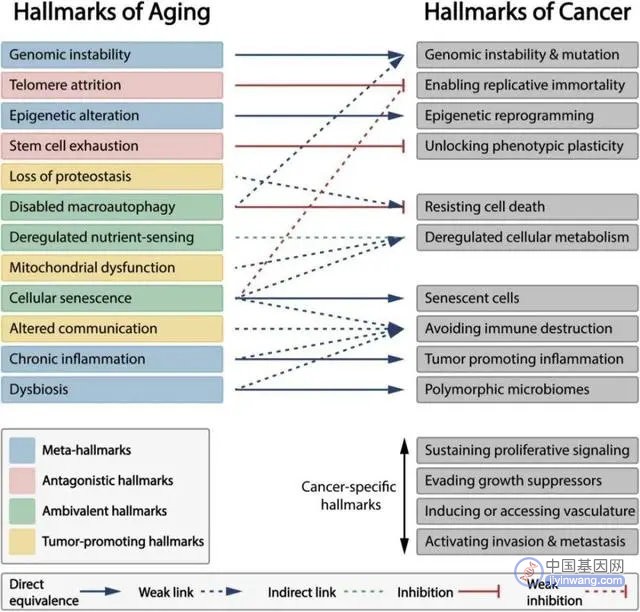
图注:衰老标识与癌症标识的关系[14]
先前研究已表明,CRISPR-Cas9系统靶向的癌细胞可以让机体对化疗药物的敏感性增加、癌细胞增殖降低和癌细胞死亡增加。针对那些其他任何方法已经无济于事的癌症,基因编辑能做什么呢?
敲除PD-1基因,恢复抗肿瘤能力
2016年,世界首个基因编辑人体实验在四川大学华西医院展开,卢铀教授团队成功使用 CRISPR技术敲除了非小细胞肺癌患者T细胞的PD-1基因。而实验患者对化疗、放疗以及其它疗法治疗均无效[15]。
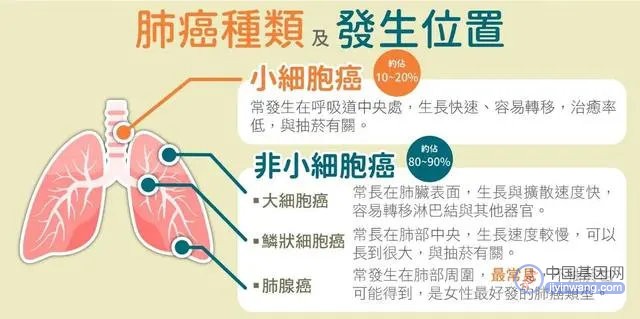
图注:肺癌种类及发生位置
PD-1基因是人体免疫反应的关键开关,删除它能够恢复T细胞的抗肿瘤能力。经CRISPR编辑后的T细胞在实验室中扩增后,再回输到患者血液中[16]。
共有22名患者参与试验,临床结果显示,使用基因编辑技术治疗后,患者产生的不良反应都为较轻微,如疲劳、发热、关节痛和皮疹等[17]。
添加受体基因,协助识别肿瘤
2019年,美国宾夕法尼亚大学的科研团队进一步验证了CRISPER/CAS9技术治疗癌症的安全性和可行性。
他们使用该技术成功编辑三名癌症患者的免疫细胞,且患者年龄都超过60岁,他们同样对之前的治疗均无反应[18]。
研究人员利用CRISPER技术编辑了他们的T细胞,去除了三个与癌细胞“狼狈为奸”,帮助癌细胞逃避免疫系统的基因,并添加了另一个基因,来帮助免疫细胞识别肿瘤。
结果显示,经过基因编辑的免疫细胞在癌症患者治疗后的几个月内持续存活,茁壮成长,发挥功能。
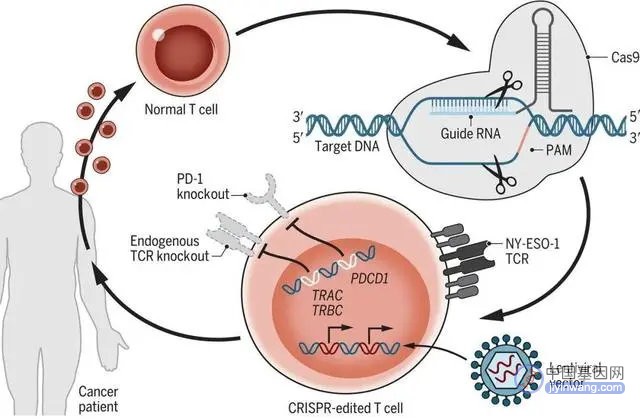
图注:癌症患者中的CRISPR-Cas9编辑T细胞
鉴于该技术可能出现的“脱靶效应”(off-target),上述人体临床实验都还只停留在测试技术的可行性和安全性的阶段,但从实际结果看来,达到了稳定病情效果。
时光派点评
目前对于胚胎基因编辑还是非常有争议的操作,且多国法律也对此明令禁止。
然而基因编辑这把上帝的剪刀有改变命运的魔力,面对癌症等绝症,只剩这最后一点希望时,该不该抓住这棵救命稻草?
基因编辑技术应该更好地服务于全人类,期待未来这项技术朝着更安全、更亲民的方向发展。
这里是只做最硬核续命学研究的时光派,专注“长寿科技”科普。日以继夜翻阅文献撰稿只为给你带来最新、最全前沿抗衰资讯,欢迎评论区留下你的观点和疑惑;日更动力源自你的关注与分享,抗衰路上与你并肩同行!
参考文献
[1]Lei, T., Xiao, B., He, Y., Qu, J., Sun, Z., & Li, L. (2019). Development and applications of CRISPR/Cas9 library screening technology in cancer research. Nan Fang yi ke da xue xue bao= Journal of Southern Medical University, 39(11), 1381-1386.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6926087/
[2]Wang, W., Zheng, Y., Sun, S., Li, W., Song, M., Ji, Q., ... & Liu, G. H. (2021). A genome-wide CRISPR-based screen identifies KAT7 as a driver of cellular senescence. Science translational medicine, 13(575), eabd2655. doi:10.1126/scitranslmed.abd2655.
[3]Houtkooper, R., Pirinen, E., & Auwerx, J. (2012). Sirtuins as regulators of metabolism and healthspan.Nature Reviews Molecular Cell Biology, 13(4), 225-238. doi: 10.1038/nrm3293
[4]Zhang, W., Wan, H., Feng, G., Qu, J., Wang, J., & Jing, Y. et al. (2018). SIRT6 deficiency results in developmental retardation in cynomolgus monkeys. Nature, 560(7720), 661-665. doi: 10.1038/s41586-018-0437-z
[5]Caobi, A., Dutta, R., Garbinski, L., Esteban-Lopez, M., Ceyhan, Y., & Andre, M. et al. (2020). The Impact of CRISPR-Cas9 on Age-related Disorders: From Pathology to Therapy. Aging And Disease, 11(4), 895. doi: 10.14336/ad.2019.0927
[6]He Jing & Wang Rong. (2022). Application of CRISPR/Cas9 gene-editing technology in Alzheimer diseaseJournal of Neuroscience and Mental Health. Journal of Neuroscience and Mental Health, 2022(11). http://111.21.214.29/KCMS/detail/detail.aspx?filename=JBJS202211005&dbcode=CJFD&dbname=CJFD2022
[7]Duan, Y., Ye, T., Qu, Z., Chen, Y., Miranda, A., Zhou, X., … Ip, N. Y. (2021). Brain-wide Cas9-mediated cleavage of a gene causing familial Alzheimer’s disease alleviates amyloid-related pathologies in mice. Nature Biomedical Engineering. doi:10.1038/s41551-021-00759-0
[8]Kim, K., Park, S., Kim, J., Lee, S., Kim, D., & Koo, T. et al. (2017). Genome surgery using Cas9 ribonucleoproteins for the treatment of age-related macular degeneration. Genome Research, 27(3), 419-426. doi: 10.1101/gr.219089.116
[8]JIA Di, WEI Jia-jia, DUAN Xiu-quan & ZHANG Rui-xian. (2022). Analysis of the disease burden of osteoarthritis in China from global perspective. Modern Preventive Medicine, 2022(13):2312-2316. doi: 10.20043/j.cnki.MPM.202201082
[9]Ma Dujun, Peng Liping, Chen Feng, Jiang Shunwan, Jiang Jinting, Gao Kun, & Lin Zhanpeng. (2021). Research strategy of gene editing technology in the gene treatment of osteoarthritis. Chinese Journal of Tissue Engineering Research, 25(2):298-303. doi: 10.3969/j.issn.2095-4344.2956
[11] Collerton, J., Davies, K., Jagger, C., Kingston, A., Bond, J., Eccles, M. P., ... & Kirkwood, T. B. (2009). Health and disease in 85 year olds: baseline findings from the Newcastle 85+ cohort study. Bmj, 2009:339. doi: https://doi.org/10.1136/bmj.b4904
[12]Zhao, L., Huang, J., Fan, Y., Li, J., You, T., & He, S. et al. (2019). Exploration of CRISPR/Cas9-based gene editing as therapy for osteoarthritis. Annals Of The Rheumatic Diseases, 78(5), 676-682. doi: 10.1136/annrheumdis-2018-214724
[13]Jaul, E., & Barron, J. (2017). Age-Related Diseases and Clinical and Public Health Implications for the 85 Years Old and Over Population. Frontiers In Public Health, 5. doi: 10.3389/fpubh.2017.00335
[14]López-Otín, C., Pietrocola, F., Roiz-Valle, D., Galluzzi, L., & Kroemer, G. (2023). Meta-hallmarks of aging and cancer. Cell Metabolism, 35(1), 12-35. doi: 10.1016/j.cmet.2022.11.001
[15]Knockout Cell Lines | KO Cell | Ubigene. (2023). Retrieved 30 March 2023, from https://www.ubigene.com/about/information/2886.html
[16]CRISPR gene-editing tested in a person for the first time - Nature. (2016). Retrieved 6 April 2023, from https://www.nature.com/articles/nature.2016.20988
[17]PD-1 Knockout Engineered T Cells for Metastatic Non-small Cell Lung Cancer - Study Results - ClinicalTrials.gov. (2023). Retrieved 30 March 2023, from https://clinicaltrials.gov/ct2/show/results/NCT02793856
[18](2023). Retrieved 30 March 2023, from https://www.pennmedicine.org/news/news-releases/2020/february/crispr-edited-immune-cells-can-survive-and-thrive-after-infusion-into-cancer-patients
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。