独木不成林,基因治疗先驱Sangamo公司衰落启示录!
1972年,美国著名生物学家Friedmann和Roblin率先提出了基因治疗的概念。如今,人们在基因治疗领域的探索已历经50余年。期间,基因治疗曾获得资本热捧。有需求、有资金、有可行性,促成了一批基因治疗公司的成立。在资本推动下,一些公司度过了一个辉煌的成长期。随后,在基因治疗不断取得突破的同时,也有相当数量的负面消息出现。随着资本退潮,基因治疗的先行者已遇到了不少问题,Sangamo公司就是其中一员。

01
成立近30载
深耕ZFN技术
所谓基因治疗,即指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,达到治疗目的。Sangamo Therapeutics(简称Sangamo)是基因治疗领域的领导者。公司通过基因编辑的强大能力生产治疗性蛋白质,把开创性科学转化为对遗传疾病患者产生重大影响的新型基因疗法。
目前,基因编辑主要有三大技术类别:锌指蛋白核酸酶(ZFN)、类转录激活因子效应物核酸酶(TALEN)以及获得了2020年诺贝尔化学奖的CRISPR/Cas9技术。
其中ZFN是第一种问世的基因编辑工具,发现于上世纪90年代末。锌指蛋白是一种转录因子,其经人工改造并与核酸内切酶进行连接,便组成了ZFN。ZFN是一种带定位系统的基因剪刀,锌指蛋白用于识别和结合特定的基因序列,FokI核酸内切酶(一种ⅡS型限制性核酸内切酶)可以通过二聚体化特异性地切割目的基因,从而实现对特定基因的编辑。ZFN具有基因修复方式多样、精准更换基因、对基因表达强度影响较小等优势。
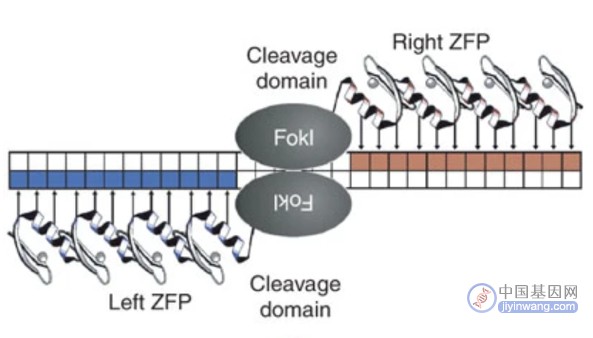
ZFN技术原理(来源:参考2)
值得一提的是,ZFN技术自面世以来,一直由Sangamo这一家公司主导。Sangamo成立于1995年,目前已将ZFN技术应用到了众多疾病领域。在ZFN技术问世后,虽然多家研究机构试图对这一技术进行优化,但多年来,只有Sangamo一家公司围绕该技术进行了临床转化开发。
最突出的,与CRISPR技术相比,ZFN作为基因编辑工具的主要劣势是开发高质量基因编辑产品费时且繁琐。虽然这种差异仍然存在,但Sangamo已经改进了开发过程,如今周期由三个月缩短至10天,并减少了相关费用。
由于Sangamo的研究和开发工作,ZFN在基因编辑领域取得了多项成绩。除了基因编辑外,Sangamo公司还开发了各种基因治疗领域的专业技术,如基因调控和细胞治疗等。公司具有四个研究平台,分别是基因治疗、细胞治疗、体内基因组编辑和体内基因组调控。Sangamo通过这些平台来开发不同方向的技术应用产品。
02
未有产品上市
但仍获制药巨擘青睐
Sangamo成立近30年来,至今未有产品上市,盈利自然无从谈起。不过Sangamo多年来似乎并未为钱发愁过。Sangamo于2012年在纳斯达克上市,之后完成过三轮融资:2013年9月,融资742万美金,帮助公司加速基因治疗发展;2018年2月,获得美国国家卫生研究院1100万美元拨款,用于研究基因编辑T细胞以消除病毒;2018年4月,获得加利福尼亚再生医学研究所800万美元拨款,用于评估ST-400(一种经过基因编辑的细胞疗法候选药物),治疗输血依赖性β地中海贫血患者。
除了募资带来的收入,Sangamo的收入来源主要源于和制药巨头们的合作。
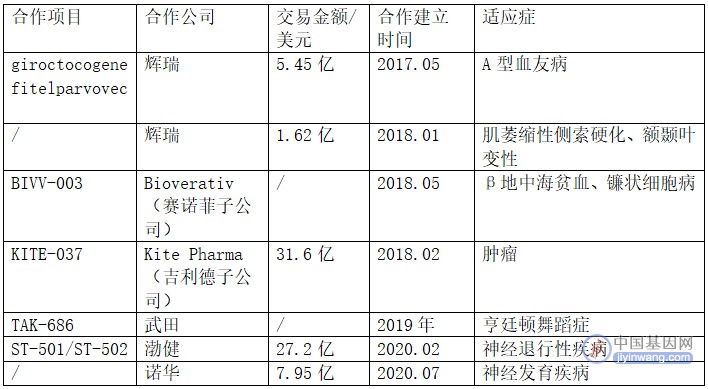
与Sangamo建立合作的大药企(来源:Sangamo官网)
2017年,辉瑞和Sangamo合作,共同开发A型血友病项目giroctocogene fitelparvovec,这是一款肝靶向AAV(腺病毒相关载体)基因疗法,辉瑞正在主导临床III期研究,以评估在中度或重度 A 型血友病成年男性参与者中的临床疗效和安全性。
2018年1月,辉瑞再次和Sangamo合作,利用锌指蛋白转录因子(ZFP-TFs)治疗与C9ORF72基因突变相关的肌萎缩性侧索硬化症(ALS)和额颞叶变性(FTLD)。
同年,Sangamo与赛诺菲旗下子公司Bioverativ合作,开发和商业化ZFN介导的基因编辑细胞疗法,以治疗β地中海贫血和镰状细胞病。
Sangamo还与吉利德旗下Kite制药达成合作,在肿瘤治疗方面展开合作。除此之外,Sangamo与武田、渤健、诺华均有合作,Sangamo通过运用公司技术平台进行早期临床试验,合作公司则执行后期临床试验和商业化发展,来开发不同方向的技术应用产品。
03
打造技术孤岛
阻碍ZFN技术发展
可以看到,在2020年以前,Sangamo还是制药巨头合作人气王,后来这一切发生了180度的大转弯。
原因还要从Sangamo成立之时开始讲起。为了避免外人分羹,其CEO Edward Lanphier决定将公司打造成一个技术孤岛。因此,ZFN基因编辑技术从一开始就被Sangamo公司垄断,从ZFN设计、优化到临床应用的整套技术体系的专利皆被Sangamo收入囊中。ZFN技术开发被Sangamo独家锁定,再也没有其它机构从事ZFN的研发。这在新技术日新月异的当下,仅仅依靠Sangamo的孤军奋战,ZFN技术发展明显滞后。
2022年1月6日,赛诺菲将镰状细胞病候选药物BIVV-003的完全控制权归还给Sangamo,今年2月,Sangamo宣布放弃开发BIVV-003;今年3月中旬,诺华和渤健也相继终止和Sangamo的合作协议。
与大药企的合作相继终止,自身又没有造血能力,Sangamo陷入财政危机,不得不裁员自保。今年4月份,Sangamo宣布了一项重组计划,调整管线优先级并裁员27%(约120人)。
在管线调整方面,Sangamo将重点关注:以Nav1.7和Prion(朊病毒)为基础的神经病学表观遗传调控组合,这是Sangamo神经学表观遗传调控领域的重点临床前项目,Nav1.7用于治疗慢性神经性疼痛,预计将于2024年提交IND,Prion计划在2025年提交IND;即将进入III期临床的基因疗法Isaralgagene civaparvovec(治疗法布里病,Fabry Disease);以及CAR-Treg疗法TX200(用于肾移植)。
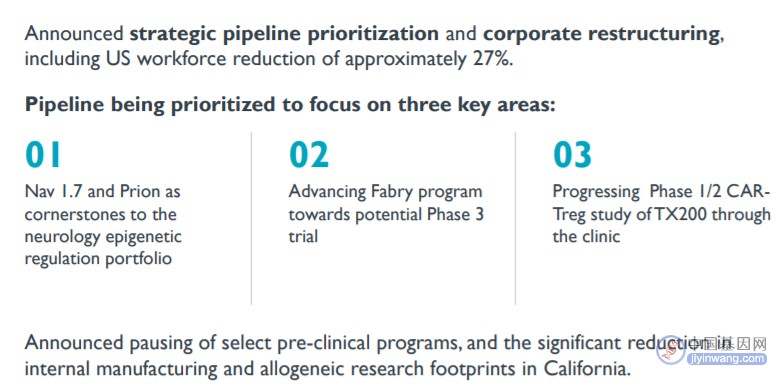
未来重点推进项目(来源:Sangamo 2023 Q1财报PPT)
同时,Sangamo还将暂停部分临床前项目、缩减部分基础设施,并根据管线进展评估进一步减少运营费用的方法。如今,Sangamo的重点项目全部为自有管线,合作项目和此前比可以说寥寥无几。
04
独木不成林
百花齐放才是春
可以说,Sangamo是医药行业专利保护的典范,也正因为在专利上的封锁,导致Sangamo在ZFN领域只能独自摸索前行,这也导致ZFN技术自问世至今仍没有获得大规模的应用,也没有突破性进展。
反观问世不到10年的CRISPR/Cas9技术,虽然曾因专利之争闹到一地鸡毛,但正是这种学术界源源不断的碰撞,快速推进了CRISPR/Cas9技术的发展。
2013年11月,CRISPR基因编辑先驱张锋教授等人创立了Editas Medicine,该公司于2016年在纳斯达克上市,也是世界第一家上市的CRISPR基因编辑公司;2014年,CRISPR基因编辑技术奠基人、诺奖得主Jennifer Doudna创立了Intellia Therapeutics;另一位诺奖得主Emmanulle Charpentier也没有闲着,其同样于2013年创立了CRISPR Therapeutics。如今,这三家企业已成为CRISPR基因编辑技术领域的头部企业。在这三家公司的影响下,目前布局依托或应用这一技术已有40余家生物技术公司创立。
这一切,让CRISPR领域呈现出百花齐放的状态。而CRISPR技术也在激烈竞争和智慧碰撞中不断有细分路径出现,如2016年碱基编辑出现,可以做到定点的修饰某一个或者某几个点突变,只改变单个目标碱基,而不会影响到其他碱基,技术更精准。如今,CRISPR/Cas9临床试验越来越多,有许多已取得非常好的治疗效果。
如Vertex Pharmaceuticals/CRISPR Therapeutics联合开发的CRISPR细胞治疗候选产品exagagglogene autotemcel(exa-cel,CTX001)已完成了向FDA提交生物制剂许可申请(BLAs),用于治疗镰状细胞病和输血依赖型地中海贫血,首款CRISPR/Cas9基因编辑疗法呼之欲出。
CRISPR基因编辑技术的出现,让人类攻克遗传病变得触手可及。而这一切背后正是因为有着大量研究人员前仆后继地去完善和改进这一技术,才推动其走向应用。
05
断尾续命后
Sangamo在孕育哪些新机遇?
尽管如今研究人员在考虑基因编辑时,出于简单原因,第一时间会想到CRISPR,但事实上,仍不能确定CRISPR技术优于ZFN。CRISPR是依赖基因靶向的向导RNA来结合特定的序列,而ZFN则不同,它是由蛋白构成的。这些结构域蛋白经过优化,可提高精确度和特异性,更适合临床基因编辑。
另外,CRISPR的脱靶效应还存在一定隐患。而Sangamo长期以来都在潜心研究ZFN,已经在人类中进行了体外和体内的基因编辑研究,积累了大量经验,如2016年,Sangamo 在Nature Communications上发表了一篇论文,他们开发了一个系统,可以选择以高比率在正确的位置切割基因的ZFN,即使在非常高的靶向活性下,仍然保证脱靶率降至检测限水平或者更低。
ZFN的优势(图片来源:Seeking Alpha)
2021年3月,Sangamo等在Science Advances发表的文章中显示,利用ZFP-TF系统在转录水平上成功降低了小鼠tau基因的表达,而且没有发现脱靶效应及显著的组织病理学改变等。
因此,ZFN技术在逆转DNA突变所致的疾病领域还是有巨大潜力的。作为一家老牌基因编辑企业,Sangamo也不会轻易认输。在经历了重大挫折后,Sangamo正在磕磕绊绊中蹚出一条路。
上文提到的Isaralgagene civaparvovec作为一款一次性输注、肝脏靶向的基因疗法,目前已获FDA和欧洲药品管理局(EMA)授予的治疗法布里病的孤儿药资格。
法布里病是一种溶酶体贮积症,由α-半乳糖苷酶A基因(GLA)突变引起,从而导致α-Gal A活性缺乏,无法正常代谢鞘氨醇三聚己糖苷(Gb3)。Gb3在体内的积聚可以破坏肾脏、心脏、神经、眼睛等重要器官。目前法布里病的标准治疗为酶替代疗法(ERT),然而此疗法不但见效慢,且无法解决大脑和神经系统中出现的症状,更可能引发患者的免疫反应,导致疗效的下降。
Isaralgagene civaparvovec通过AAV向患者肝脏递送功能性GLA基因拷贝,从而使细胞恢复生产α-Gal A。初步临床数据显示,在5位治疗时间最长的患者中,其体内递送GLA基因所编码的α-Gal A活性持续上升,维持时间最长可达15个月。第6位患者的α-Gal A活性则在治疗后两周内达到正常范围,所有患者耐受性良好。Sangamo正在规划临床III期试验。
另外,与辉瑞公司合作的血友病A项目giroctocogene fitelparvovec预计于2024年上半年获得顶线数据,并于2024下半年向FDA提交BLA。
用于实体器官移植的CAR-Treg疗法TX200,Sangamo正在计划通过I/II期临床研究推进其在肾移植中的应用,并计划加速剂量递增研究。
在开源方面,今年7月17日,Sangamo宣布与礼来的全资子公司Prevail Therapeutics签署了评估和期权协议。根据协议条款,Sangamo将提供AAV衣壳给Prevail以供其进行体内和体外的研究,Prevail可以行使选择权,许可这些衣壳用于多种未公开的神经靶点。Sangamo以此获得Prevail的预付款。如果Prevail更进一步,对所有目标行使选择权,且Prevail的产品在美国和欧洲获得批准,Sangamo就有资格获得4.15亿美元的发展里程碑和7.75亿美元的商业里程碑。
7月20日,Sangamo和Chroma Medicine宣布,Chroma将使用Sangamo的ZFPs库开发用于表观遗传编辑的锌指蛋白。Chroma将针对中枢神经系统外的特定靶点来评估Sangamo新型锌指蛋白,并支付技术获取预付款。如果Chroma激活任一或所有靶点的选择权,Sangamo将有权获得选择权行使费用、潜在的研发和商业化里程碑付款等。
一系列的技术授权合作,使Sangamo能够获得宝贵的现金流,一解燃眉之急。
回看Sangamo的高开低走,在为其惋惜的同时,我们应该认识到不论在科学上的争执还是商业上的竞赛,最终应是以释放造福人类的潜力为前提的,这一初心不能丢。在自己建造的专利堡垒中独行许久的Sangamo也在发生改变,目前正在不断拓展新方向,如探索CAR-Treg、AAV基因疗法以及开发自己的基因疗法递送平台等,体现出Sangamo正在持续拥抱新趋势。非常期待看到这家老牌基因编辑公司在人类疾病治疗史上写下浓墨重彩的一笔。
参考文献:
1.Sangamo官网.
2.Miller, J., Holmes, M., Wang, J. et al. An improved zinc-finger nuclease architecture for highly specific genome editing. Nature Biotechnology (2007).
3.Susanne W., Sarah L. D., Bryan Z. et al. Persistent repression of tau in the brain using engineered zinc finger protein transcription factors. Science Advances (2021).
4.《Sangamo公司CEO:基因疗法领域真正的腾飞在于给药方式的创新》,药明康德,2017-09-18.
5.Kevin Davies, Edward Lanphier. Sanguine About Sangamo: An Interview with Edward Lanphier. The CRISPR Journal (2019).
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。