细胞&基因治疗新篇章:张珍/史俊炜团队建立高效且低毒的原代细胞基因编辑系统
CRISPR-Cas系统是细菌和古菌中普遍存在的抗病毒防御系统,2012年6月28日,Jennifer Doudna、Emmanuelle Charpentier 在Science期刊发表论文,揭示了CRISPR-Cas9的作用机制,并指出了其作为基因组编辑工具的潜力。此后,在张锋、George Church、刘如谦等人的进一步推动下,CRISPR-Cas基因编辑技术得到了快速发展。
如今,CRISPR-Cas系统已经被广泛用作分子生物学的标准实验室工具,并在基因功能研究、药物靶点筛选、遗传疾病治疗、作物育种等领域取得了突破性成就。此外,CRISPR-Cas系统还被用于修饰改造细胞疗法(例如CAR-T细胞疗法),然而,对原代细胞进行CRISPR-Cas基因编辑仍面临着很大挑战。其中一个重要原因是,缺乏能够高效且低毒性的方法让CRISPR-Cas系统进入原代细胞并发挥作用。
目前常用的CRISPR-Cas系统的递送方法主要有病毒转染和电穿孔(电转染)。病毒转染存在着病毒基因和宿主基因整合的风险,并且对于分子量相对较大的Cas蛋白转染效率低下;电穿孔虽然可以高效递送CRISPR-Cas系统,但对细胞的损伤很大,会干扰细胞正常的转录水平和信号转导,而且电穿孔需要借助特殊的仪器及试剂,这大大增加了基因编辑的成本。因此,建立针对原代细胞的高效、安全、简易的基因编辑系统具有重要意义。
近日,宾夕法尼亚大学的史俊炜、Shelley L. Berger和E. John Wherry团队(第一作者张珍博士)在Nature Biotechnology期刊发表了题为:Efficient engineering of human and mouse primary cells using peptide-assisted genome editing 的研究论文。
该研究开发了名为多肽辅助的基因编辑(Peptide-Assisted Genome Editing,PAGE) 新方法 ,PAGE系统能够实现对人类原代细胞的更高效、更快速且更低毒性的基因组编辑。
PAGE系统为下一代细胞疗法和基因疗法的开发奠定了技术基础,有望书写癌症及遗传疾病治疗发展的新篇章。

在这项研究中,研究团队探索了使用病毒来源的小蛋白质片段(多肽)来更有效地引导CRISPR-Cas分子穿过人类原代细胞的细胞膜并进入细胞核。
具体来说,该研究发现,将来自HIV转录反式激活因子(TAT)的 细胞穿膜肽 和来自甲型流感病毒血凝素(HA2)的内体逃逸辅助肽形成融合肽TAT-HA2,将其与CRISPR-Cas系统联合,TAT-HA2能够促进CRISPR-Cas系统进入人类和小鼠的原代细胞及其细胞核。
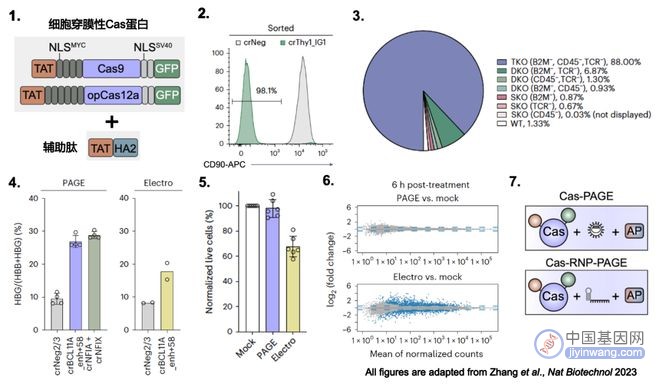
研究团队将该系统命名为多肽辅助基因编辑系统(Peptide-Assisted Genome Editing, PAGE)。该系统包括了具有细胞穿透性的Cas9或Cas12a蛋白,以及帮助Cas蛋白从内体逃逸的辅助肽TAT-HA2(图1)。
PAGE系统只需与原代细胞共孵育30分钟,便可实现对人和小鼠T细胞以及人造血干祖细胞的高效基因编辑。同时,与电穿孔方法相比,PAGE对原代细胞的损伤很小,并且不影响细胞内的转录水平。因此,PAGE对原代细胞的基因编辑具有划时代的意义,也为将来广泛的临床应用提供可能。

史俊炜教授(左),张珍博士(右)
论文第一作者张珍博士对《生物世界》表示,相对于传统CRISPR-Cas递送系统,PAGE具有以下几点显著优势:
1、安全、高效、简便、经济。首先PAGE不借助病毒转染,所以降低了病毒基因和宿主基因整合的风险;其次,PAGE对单基因编辑效率高达98%(图2),对三基因编辑效率高达88%(图3),并且编辑过程只需要30分钟;此外,辅助肽合成价格低廉,细胞穿透性的Cas蛋白与普通Cas蛋白的纯化工艺相仿,所以PAGE的使用门槛很低。
2、可用于多种原代细胞的基因编辑。PAGE除高效编辑人和小鼠的原代T细胞外,还可以高效编辑人造血干/祖细胞(图4),为基因治疗的推广提供可靠的技术支持。
3、对细胞毒性小,不影响细胞转录水平。与电穿孔方法相比,经PAGE处理过的CAR T细胞,活细胞比例达95%以上,而经电穿孔处理的细胞只有65%左右(图5),因此PAGE会大幅节省CAR-T细胞的体外培养成本;另外同对照相比,PAGE处理过6小时后的CAR-T细胞无差异性基因表达,电穿孔有近2000个差异基因表达(图6)。
4、使用形式多样,可满足基础研究及临床治疗的不同需求。PAGE既可以直接递送Cas蛋白,也可以递送核糖核酸蛋白复合体(RNP)(图7),此外PAGE既可用于CRISPR-Cas9系统也可用于CRISPR-Cas12a系统。
除了在细胞疗法和基因疗法方面的潜在用途外,PAGE系统在基础研究领域也有着广泛应用前景。目前标准的CRISPR-Cas系统向细胞递送的效率低下,这意味着通过基因编辑来创建疾病小鼠模型通常是一个多步骤且耗时的过程,而高效、低毒性的PAGE系统有望简化、加速疾病小鼠模型的构建。
综上所述,PAGE对原代细胞进行基因编辑具有常规方法所无法比拟的优势。PAGE基因编辑系统高效、安全、低创、简便以及其在基础研究和临床治疗的广泛应用前景,为将来基因编辑翻开崭新的一页 (PAGE) 。
论文链接:https://www.nature.com/articles/s41587-023-01756-1
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。