填补细胞疗法的缺失一环:基因改造B细胞,这项研究实现效率大提升
近年来,以CAR-T疗法为代表的细胞疗法方兴未艾,迅速成为生物医药领域的焦点。多种细胞疗法不仅已经在血液肿瘤领域给患者带来新生,而且在实体肿瘤、传染性疾病、自身免疫病等广泛领域同样展现出巨大的潜力,有望改写治疗格局。
目前免疫疗法的主要改造对象是T细胞。相比之下,另一类主要免疫细胞——B细胞似乎受到了冷落。但事实上,对B细胞的工程化改造同样潜力巨大。B细胞构成了体液免疫的基础,一旦被抗原激活,初始B细胞就会增殖分化,形成生发中心,并分化成记忆B细胞与浆细胞。其中,浆细胞也被称作抗体分泌细胞,是抗体的生产工厂,持续向血清中释放大量抗体——大多数疫苗的保护作用正是来源于此。
因此如果能借助基因编辑工具改造B细胞、使其表达针对特定病毒的广谱中和抗体再输回体内,将有望为包括HIV在内的疾病提供全新疗法。再加上B细胞在外周血液中含量丰富、易于获取,并且具有高蛋白表达能力,这些特征使得B细胞成为细胞疗法的潜在靶点。
目前,这种工程化改造B细胞的研究已经在许多小鼠实验中展现出了应用潜力,但距离临床试验仍有需要跨越的障碍。除了安全性、持续性、疗效等问题,另一个急迫的挑战是如何从小鼠实验放大到非人灵长类等大动物。非人灵长类动物,尤其是常见模式动物恒河猴,为检验B细胞疗法的相关指标提供了理想的模型。但要从小鼠实验步入灵长类动物试验,找到更加高效的B细胞改造手段是绕不开的难题。
近期,在一项发表于Journal of Visualized Experiments(JoVE)期刊的研究中,由美国洛克菲勒大学Michel Nussenzweig教授领导的团队创建了一套利用CRISPR/ Cas9系统,在体外快速、高效地编辑恒河猴原代B细胞的全新方案,为基于恒河猴等非人灵长类动物模型的B细胞基因疗法临床前研究提供了强有力的工具。

谈到CRISPR/ Cas9基因编辑工具,我们熟悉的称呼是“基因魔剪”。事实上,“剪开”基因只是开始,在DNA双螺旋结构断裂后,细胞会迅速启动修复机制。其中,同源定向修复(HDR)是一类常见的修复机制。这个修复过程需要引入一套包含了目标基因序列的外源DNA作为修复模板,从而实现精准的基因编辑。
在这项研究中,研究团队应用CRISPR/ Cas9核糖核蛋白(RNPs)和重组腺相关病毒6(rAAV6)作为同源定向修复模板(HDRT),用于对体外培养的恒河猴B细胞进行精准的基因编辑。
要将基因编辑工具递送至目标区域,“交通工具”也就是载体必不可少。腺相关病毒(AAV)是一类理想的载体,由于存在复制缺陷,AAV仅在腺病毒等辅助病毒存在的情况下才会自我复制,因此安全可靠。而在AAV基础上改造得到的重组腺相关病毒(rAAV)进一步避免了基因整合风险,并且具有宿主细胞范围广、免疫原性低,在体内表达外源基因时间长等优点,被视为最有前途的载体之一。这项研究使用的rAAV6正是其中之一。
然而,rAAV的高效、低成本生产始终是一道难题。传统的三质粒包装系统是由质粒通过转染进入HEK293细胞来进行rAAV的包装,成本高、耗时长且可放大性有限。因此,这项最新研究使用了不依赖转染的大规模、高效生产rAAV的新一代病毒载体生产技术TESSA™。
TESSA™技术由药明生基全资英国子公司OXGENE自主开发,其基本思路是利用腺病毒的辅助作用提升rAAV生产效率,同时采用了诱导型启动子来避免rAAV生产过程中腺病毒污染。TESSA™充分利用了腺病毒的生命周期:腺病毒的早期基因供了rAAV复制和包装辅助功能,可以加以利用;同时通过引入操控基因开关——四环素控制元件遏制晚期基因表达,阻止腺病毒进入合成结构蛋白的晚期阶段,从而避免了腺病毒复制所带来的污染。在今年迈阿密举办的首届先进疗法颁奖典礼上,药明生基还凭借TESSATM技术荣获2022年度技术颠覆者大奖。
在这项研究中,Nussenzweig教授团队对比了TESSA™ 和传统的无辅助三质粒共转染途径生产rAAV6的效果。结果显示,相比于传统手段,应用TESSA™可将rAAV6的产量平均提升30~40倍,实现了快速、高效的恒河猴B细胞基因编辑。
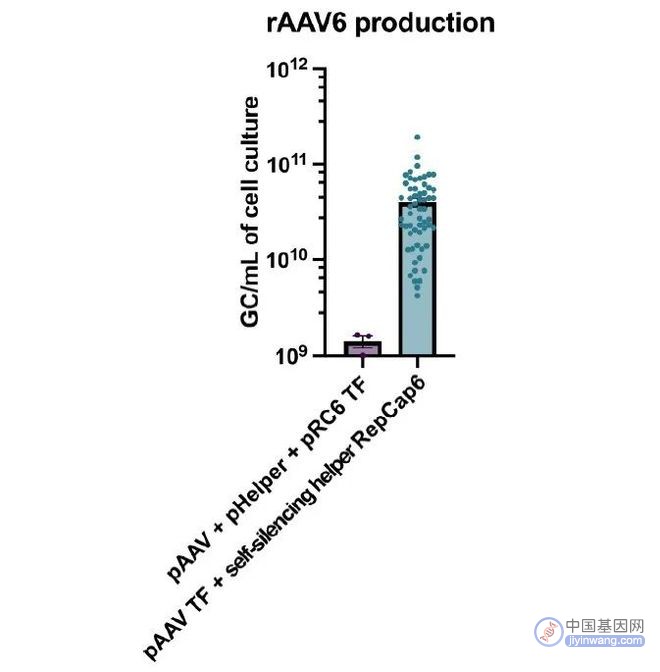
应用TESSA™实现了rAAV6的高产量(图片来源:参考资料[1])
除了提升rAAV6生产效率之外,这项研究还在多个环节进行了优化,来实现B细胞改造效率的大幅提升。例如,电转染后添加1%的二甲基亚砜(DMSO),能够将基因编辑效率提升40%;电转后将细胞与rAAV6进行数个小时的高浓度共培养,同样得以提升编辑效率。
最终,这项研究提供了一种综合策略,采用了快速、高效、低成本且稳定的方式来制备rAAV6作为HRDT,大大提升了恒河猴B细胞基因编辑的可行性和可放大性,为利用灵长类动物模型进行B细胞疗法的非临床研究奠定了重要基础。
与细胞与基因疗法常见的CDMO不同,药明生基作为一家以创新为自我驱动的新一代CTDMO,拥有2大革新性技术——新一代rAAV 生产工艺TESSA™ 和慢病毒载体创新型技术Lenti VV,通过对传统工艺的革新,改变着细胞与基因疗法的格局。
参考资料:
[1] Harald Hartweger et al., (2023) Gene Editing of Primary Rhesus Macaque B Cells. JoVE. DOI: 10.1126/science.adf0566
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。