研发投入最多的十家药企,它们看好哪些细胞和基因疗法?
编者按:近年来,新分子疗法成为医药产业的关注焦点,为这个行业带来了革命性的创新及无限的可能性。这些前沿疗法不仅在治疗罕见疾病方面表现出惊人的潜力,同时也为一些常见疾病开启了崭新的治疗路径。为了让读者更深入地了解这个创新领域,药明康德的内容团队研究了近期研发投入最为活跃的十大药企的产品管线,深度探讨它们的新分子研发管线布局及其最新进展,以期为大家展示新分子疗法如何塑造医疗行业的未来格局。

本系列讨论的新分子疗法涵盖了寡核苷酸疗法(包括RNA疗法、反义寡核苷酸等)、细胞和基因疗法、蛋白降解疗法、多特异性抗体,以及抗体偶联药物(ADC)。这些创新疗法各有其独特之处,它们的出现从根本上颠覆了传统治疗的范式。为了更系统地呈现这些信息,我们将内容分为四篇,与读者逐一分享。在今天的内容中,我们将详细盘点细胞和基因疗法领域的最新研发进展。
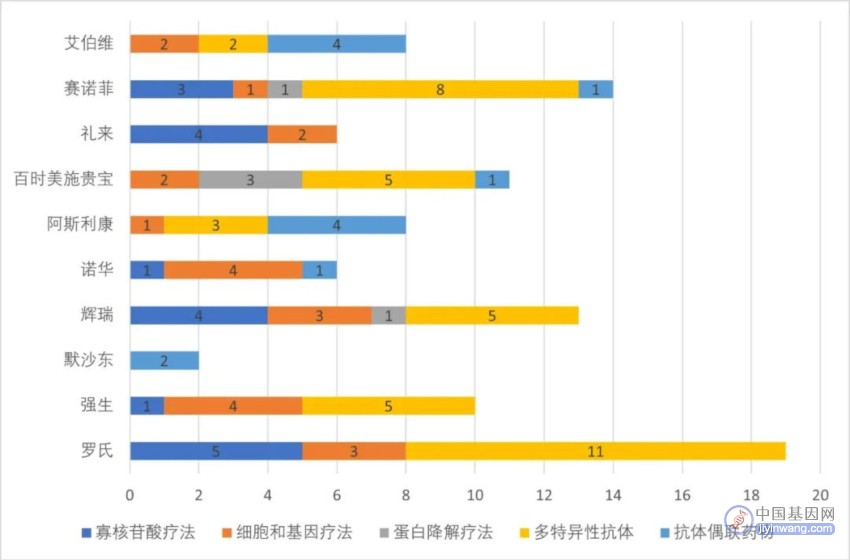
▲2022年研发投入最多的十家药企新分子疗法管线布局(药明康德内容团队制图)
在医疗领域的不断进步中,细胞和基因疗法显得尤为独特,它们直接针对疾病的根源进行治疗,甚至有可能实现疾病的完全治愈,为那些曾被认为难以医治的疾病提供了新的希望。
细胞疗法的核心在于通过改变或修复某些细胞群来治疗疾病。在此过程中,治疗性细胞产品在体外经过培养或修饰后,再注入到患者体内。这些细胞可能来自患者自身(即自体细胞)或是他人(即同种异体细胞)。基因疗法则通过替换、灭活或引入新的基因到细胞中来治疗疾病,包括体内基因疗法(直接将治疗基因递送到患者特定病患部位)和体外基因疗法(将特殊细胞进行基因工程改造后移植入人体)。值得注意的是,某些疗法既包括细胞疗法也包括基因疗法的特点。这些疗法首先在体外改变特定细胞中的基因,然后再将其植入患者体内发挥作用。
随着这一领域的技术日益成熟,众多医药公司也加大了研发力度,以期能深入挖掘细胞和基因疗法的潜力,并迅速将其应用于实际的临床治疗中。
细胞疗法
现阶段,2022年度研发投入最多的10家药企中,有6家选择在细胞疗法领域进行布局。从技术角度分析,CAR-T技术依然是这一领域中最受欢迎的技术类型。不过,除了CAR-T,其他细胞治疗技术,如视网膜色素上皮(RPE)细胞疗法、NK细胞疗法和T细胞抗原受体细胞疗法(TCR-T)等,也正逐步崭露头角。从治疗适应症来看,细胞疗法主要应用于血液系统恶性肿瘤领域,尤其是多发性骨髓瘤,这也成为了众多公司的研究焦点。目前,大部分细胞疗法还处于1期或2期临床研发阶段,这表明细胞疗法领域仍是一个机遇和挑战并存的新兴领域。
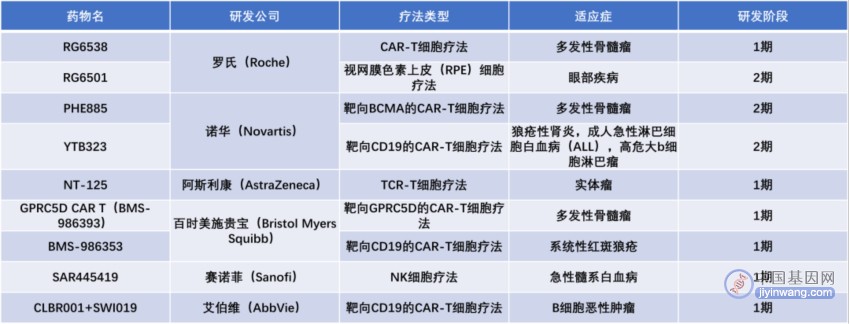
▲2022年研发投入最多的十家药企旗下在研细胞疗法
01
CAR-T细胞疗法
候选药物:RG6538(P-BCMA-ALLO1)
P-BCMA-ALLO1是罗氏和Poseida Therapeutics合作开发的靶向B细胞成熟抗原(BCMA)的同种异体CAR-T候选产品,它采用了Poseida公司专有的Cas-CLOVE位点特异性基因编辑系统制造,目前正在开发用于复发/难治性多发性骨髓瘤的治疗。2022年12月公布的1期临床试验数据表明,P-BCMA-ALLO1与自体CAR-T疗法相比具有相似或更好的抗肿瘤作用。在可供评估的6位患者中,该细胞疗法的总缓解率(ORR)为50%(3/6),既往接受过BCMA靶向治疗患者的ORR为66%(2/3),高危细胞遗传学患者的ORR为50%(2/4)。获得缓解的患者中,有2例获得了部分缓解(PR),1例获得了非常好的PR。此外,该疗法还表现出了良好的耐受性。
候选药物:PHE885
PHE885是诺华公司开发的一款靶向BCMA的CAR-T细胞疗法,其研发基于该公司的下一代CAR-T细胞疗法技术平台T-Charge。T-Charge平台能够保存T细胞的干细胞特征,即自我更新和成熟的能力。因此,当基于此平台的CAR-T细胞被输注到患者体内时,它们可以大量增殖,并减少T细胞耗竭。与已有CAR-T疗法相比,使用T-Charge平台生产的CAR-T细胞在输注时所需的剂量可以减少10-50倍,这不仅预期可以为患者带来更为持久且效果显著的治疗效果,还能降低产生严重不良事件的风险。
PHE885目前正在2期临床试验中进行测试。根据先前发布的1期临床试验早期结果,接受5×106或14.3×106个CAR-T细胞剂量治疗的复发性/难治性多发性骨髓瘤患者中,最佳ORR达到100%,且缓解率随时间推移而升高。
候选药物:YTB323,BMS-986353(CC-97540),CLBR001+SWI019
本文所分析的10家大型药企旗下在研的细胞疗法中,有3款疗法均为以CD19为靶点的CAR-T细胞疗法,分别是YTB323,BMS-986353和CLBR001+SWI019。
YTB323也是诺华公司基于其T-Charge平台所开发的靶向CD19的CAR-T细胞疗法,这种疗法可用于治疗狼疮性肾炎,成人急性淋巴细胞白血病(ALL),以及高危大B细胞淋巴瘤。目前,YTB323治疗狼疮性肾炎和高危大B细胞淋巴瘤的临床试验已经进入2期临床研究阶段,但针对成人ALL的试验尚处于1期临床阶段。值得注意的是,在治疗复发/难治性弥漫性大B细胞淋巴瘤患者的1期临床试验中,YTB323达到75%的完全缓解率。
BMS-986353是百时美施贵宝公司开发的一款靶向CD19的CAR-T细胞疗法,该疗法目前正在一项多中心、开放标签的1期临床试验中进行测试,以评估其在重症难治性系统性红斑狼疮(SLE)患者中的耐受性、初步疗效和药代动力学。
CLBR001+SWI019是一种活性可控的CAR-T细胞疗法,最初由斯克里普斯研究所旗下Calibr实验室开发。后来,艾伯维公司与Calibr实验室达成合作,共同进行了CLBR001+SWI019的首次人体临床试验。
这种细胞疗法由2部分组成,包括一种在CAR-T细胞表面表达的名为CLBR001的嵌合抗原受体(CAR),以及一种名为SWI019的衔接蛋白。CLBR001的靶点并不是肿瘤细胞表面表达的抗原,而是靶向SWI019。SWI019蛋白的一端能够识别肿瘤细胞表达的CD19抗原,另一端则能够与CLBR001表达的CAR结合。因此,当SWI019和带有CLBR001的CAR-T细胞同时输注到患者体内后,它们可以联合靶向CD19,并且激活CAR-T细胞消灭肿瘤。
这种疗法的优势在于,SWI019具有较短的半衰期,因此在激活CAR-T细胞之后会被降解,从而起到关闭CAR-T细胞活性的效果,减少因过度炎症激活引起的不良反应。另一个优势在于,只要再输入SWI019,就能够重新激发CAR-T细胞的活性。而且,如果患者的肿瘤对靶向CD19的CAR-T疗法产生耐药性,研究人员可以输入靶向其它抗原的融合蛋白,让CLBR001靶向其它抗原,因此有望克服肿瘤的耐药性。
CLBR001+SWI019已在治疗B细胞恶性肿瘤患者的1期临床试验中进行测试。其初步试验结果显示,这款疗法在治疗接受过多种前期治疗的B细胞恶性肿瘤患者时,不但表现出67%的完全缓解率,而且将不良反应的持续时间缩短到2-3天,显著短于获批的CAR-T疗法(5-17天)。
候选药物:GPRC5D CAR T(BMS-986393)
GPRC5D是在多发性骨髓瘤细胞表面高度表达的一种孤儿受体,但它在其他组织中的表达水平相对有限,因此被认为是治疗多发性骨髓瘤的理想靶点。百时美施贵宝公司研发的BMS-986393正是针对GPRC5D这一靶点的自体CAR-T细胞疗法,目前该疗法已进入1期临床试验阶段。
在治疗复发/难治性多发性骨髓瘤患者的1期临床试验中,在进行中期分析时,BMS-986393展现良好的安全性,所出现的细胞因子释放综合征(CRS)和神经毒性大多为低级别和暂时性的。在中位追踪期5.82个月的患者分析中,患者达到89.5%的ORR以及47.4%的完全缓解率(CRR)。
02
其他类型的细胞疗法
候选药物:RG6501(OpRegen)
OpRegen是一种基于视网膜色素上皮细胞(RPE)的细胞替代疗法,以治疗眼部疾病。该疗法最初由Lineage Cell Therapeutics开发,该公司于2021年12月与罗氏旗下基因泰克(Genentech)达成了全球独家合作和许可协议,共同开发和商业化OpRegen。该疗法目前处于2期临床研究阶段。
OpRegen使用的是胚胎干细胞分化出的RPE,它能取代患者体内缺少的RPE细胞。这些细胞可以支持光感受器的更新、再生,并维持视网膜外层的内环境稳定。今年5月公布的1/2a期临床试验数据证明,施用OpRegen细胞后,年龄相关性黄斑变性(AMD)的地图样萎缩(GA)患者眼睛的视网膜外结构和视觉功能获得了持续的改善。
候选药物:NT-125
NT-125是Neogene Therapeutics公司开发的一种针对癌症新抗原的多特异性自体T细胞受体疗法,用于治疗晚期实体瘤。该疗法包含多达五个不同的新抗原特异性T细胞受体,能够靶向由HLA I类和HLA II类分子呈递的众多新抗原,旨在为广大患者提供更为高效的治疗方案。
2022年5月,NT-125的临床试验申请(CTA)得到了荷兰监管机构的批准,目前该疗法正在1期临床试验中进行评估。值得一提的是,2022年11月,Neogene公司以3.2亿美元的价格被阿斯利康公司收购,这款疗法也被阿斯利康纳入自身产品管线中。
候选药物:SAR445419
SAR445419是赛诺菲研发的一种异基因NK细胞疗法,目前正在进行针对急性髓系白血病的1期临床试验,但相关的临床试验数据尚未公开。
基因疗法
基因疗法领域也吸引了各大药企的关注,并投入大量研发力量。其中,眼科疾病和血友病是两种最常见的适应症。此外,基于腺相关病毒(AAV)的基因疗法在多种疾病治疗中都得到了应用,已经成为了这个领域最为常见的治疗策略。在该领域的研发进程中,从1期到3期临床阶段的项目分布相对均衡,但处于3期临床阶段的项目略有数量优势,这暗示着该领域的技术正逐渐走向成熟,相信在不久的将来我们有望见证更多基因疗法的上市。
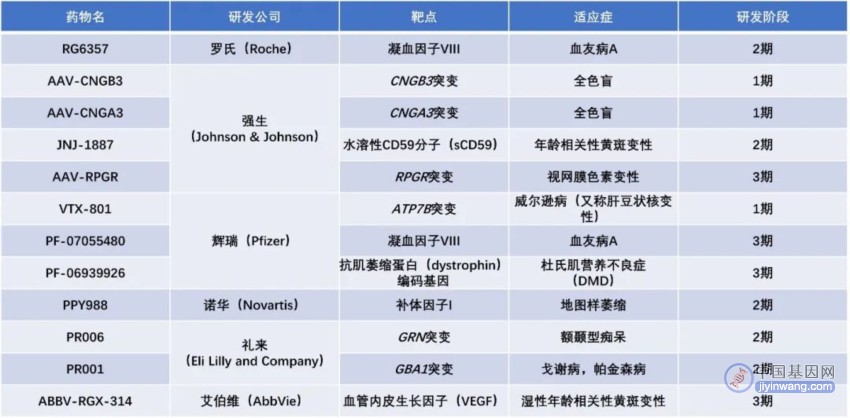
▲2022年研发投入最多的十家药企旗下在研基因疗法
候选药物:RG6357(SPK-8011)
SPK-8011是罗氏旗下的Spark Therapeutics公司开发的一款治疗血友病A的基因疗法,该疗法利用AAV载体表达密码子经过优化的凝血因子VIII的转基因,目前它正在2期临床研究中进行检验。
1/2期临床试验的多年随访结果显示,截至2022年10月4日,91%(21/23)接受治疗的患者表现出持久的凝血因子VIII表达,其中两名参与者已经完成5年随访。在21名持久表达因子VIII的参与者中,包括所有出血类型的年出血率(ARB)降低92%(95% CI:78-97%)。此外,数据同时显示患者因子VIII使用量大幅度减少,接受基因疗法治疗后的每年因子VIII输注次数为0.3,接受治疗前为85.5。

候选药物:AAV-CNGB3,AAV-CNGA3,JNJ-1887,AAV-RPGR(botaretigene sparoparvovec)
AAV-CNGB3和AAV-CNGA3是由强生旗下杨森(Janssen)公司和MeiraGTx共同开发的基因疗法,旨在恢复视锥功能,通过视网膜下注射将基因治疗产品输送到视网膜中大多数视锥所在的眼睛区域。AAV-CNGB3被美国FDA授予孤儿药资格认定、罕见儿科疾病认定和快速通道资格,以及EMA授予的PRIME认定,用于治疗由CNGB3基因突变引起的色盲。目前这两款疗法都处于临床1/2期临床研究阶段。
除了上述两款疗法,强生旗下另外两种基因疗法分别针对年龄相关性黄斑变性和视网膜色素变性等适应症开展了临床研究。JNJ-1887是一种用于治疗地图样萎缩患者的基因疗法,强生旗下的杨森公司于2020年12月宣布与Hemera Biosciences公司达成合作,从而囊获这款一次性门诊玻璃体内注射疗法。该产品被设计用以增加水溶性CD59分子(sCD59)表达,以保护视网膜细胞并减缓或避免疾病进展。JNJ-1887的1期临床研究结果曾于2022年美国眼科学会(AAO)年会以口头报告的形式公布。该1期临床研究在成人晚期干性AMD合并地图样萎缩患者中进行单次玻璃体内注射JNJ-1887,患者(n=17)在没有类固醇预防的情况下按低、中、高剂量顺序入组。在两年的随访期间,所有三种剂量的JNJ-1887均达到了主要安全性终点。此外,在超过6个月的时间中显示,病患的地图样萎缩病变扩展速率呈现持续下降趋势。杨森正在海外开展一项2b期临床研究,评估JNJ-1887治疗60岁或以上晚期干性AMD伴地图样萎缩患者的疗效和安全性。
AAV-RPGR旨在治疗因RPGR突变导致的X连锁视网膜色素变性,该疗法在在临床1/2期试验MGT009中获得了积极的初步结果。数据分析显示此基因疗法具有良好的安全性,并改善遗传性X连锁视网膜色素变性(XLRP)病患的视力。目前该疗法已进入3期临床研究阶段。
候选药物:VTX-801
VTX-801是由辉瑞和基因疗法新锐公司Vivet Therapeutics合作开发的一款针对威尔逊病(Wilson Disease,WD)的在研基因疗法,该疗法已被FDA和欧盟委员会授予了孤儿药资格,此外还获得了美国FDA授予的快速通道资格。
威尔逊病是一个由于肝细胞中编码ATP7B蛋白的基因存在缺陷而触发的疾病,这一缺陷使得铜的正常胆汁排泄途径受阻。因此,铜会在肝脏及其他器官(包括中枢神经系统)中过量积累,导致一系列健康问题。VTX801使用新型改造的AAV载体将ATP7B基因的短小功能型版本转运到携带缺陷基因的肝细胞中,并被转录为治疗性蛋白,有望恢复铜代谢、减少肝脏损伤和改善肝功能。目前VTX801正处于1期临床开发阶段,相关试验数据目前尚未披露。
候选药物:PF-07055480(giroctocogene fitelparvovec)
血友病A是由于缺乏凝血因子VIII而导致的一种罕见遗传性出血性疾病,以反复出血及其相关并发症为主要临床表现。Giroctocogene fitelparvovec是由辉瑞和Sangamo Therapeutics合作开发的一种针对血友病A的基因疗法。这款疗法采用了重组AAV血清型6载体,可将编码B结构域缺失的凝血因子VIII的序列递送给血友病患者。美国FDA已经授予了giroctocogene fitelparvovec孤儿药资格、快速通道资格和再生医学先进疗法(RMAT)认定。

Giroctocogene fitelparvovec目前正在3期临床试验中进行测试。根据先前发布的1/2期临床试验结果,最高剂量组的5名患者在治疗后第一年的平均年化出血率(ABR)为0,整个随访期间ABR为1.4,最高剂量组中没有受试者继续接受预防性治疗。在研究过程中,giroctocogene fitelparvovec总体耐受良好,最高剂量队列中的一名患者出现了治疗相关的严重不良事件——即低血压(3级)和发热(2级),并出现头痛和心动过速症状。这些不良事件在输注giroctocogene fitelparvovec后6小时发生,并在输注后约12小时缓解。此外,没有报告其他与治疗相关的严重不良事件。
候选药物:PF-06939926
PF-06939926是辉瑞旗下一款在研静脉注射基因疗法。它将由人类肌肉特异性启动子控制的“迷你”抗肌萎缩蛋白(mini-dystrophin)转基因装在腺相关病毒9(AAV9)载体中。AAV9病毒载体具有向肌肉组织靶向递送转基因的能力。这款在研疗法已经被FDA授予孤儿药资格、罕见儿科疾病药物认定和快速通道资格。
既往发布的1b期研究结果显示,9名6至12岁的杜氏肌营养不良症(DMD)患者接受了PF-06939926的治疗。治疗12个月后,患者显示出持久和具有统计学意义的显著改善,包括微型抗肌萎缩蛋白表达的持续水平,以及NorthStar门诊评估量表(NSAA)得分的改善。目前,PF-06939926已经进入3期临床开发阶段,并于2021年1月完成首例患者给药。
候选药物:PPY988(GT005)
GT005最初由眼部基因治疗公司Gyroscope Therapeutics开发,诺华于2021年12月收购了Gyroscope公司的全部剩余股份,并将GT005纳入自身管线中。
GT005是一款基于AAV2载体的一次性基因疗法,在视网膜下方注射给药。它旨在通过增加CFI蛋白的产生,恢复免疫系统中过度活跃的补体系统平衡,以减缓或阻止干性年龄相关性黄斑变性的进展。补体过度激活可导致损伤健康组织的炎症,它与AMD的发生和发展密切相关,而CFI蛋白被证明能调节补体系统的活性。该疗法目前已在2期临床试验中进行测试,以评估其作为单一疗法治疗伴有地图样萎缩的AMD患者的安全性和有效性。
候选药物:PR006,PR001
PR006和PR001最初都是由Prevail Therapeutics开发的基于AAV的基因疗法。2020年12月,礼来以10.4亿美元收购Prevail Therapeutics,并将该公司旗下包括PR006和PR001在内的处于临床开发阶段的基因治疗产品纳入自身研发管线。
PR006是一款基于AAV9载体、表达正常GRN基因的基因疗法。不少额颞痴呆患者带有GRN基因突变,这种基因编码了一种叫做progranulin的蛋白,对于大脑里的免疫细胞有着重要的作用。一旦出现突变,患者神经元里的蛋白降解功能就会受影响,最终导致神经退行病变。PR001也利用了AAV9载体将GBA1基因的功能性拷贝传递到大脑,以治疗携带GBA1突变的帕金森病和神经元病性戈谢病患者。
这两款疗法正处于2期临床开发阶段,目前尚无相关临床数据披露。
候选药物:ABBV-RGX-314(原名RGX-314)
ABBV-RGX-314是艾伯维与REGENXBIO合作研发的一款潜在一次性的基因疗法。该疗法使用REGENXBIO的NAV AAV8载体递送编码治疗性抗体片段的基因,该抗体片段可抑制血管内皮生长因子(VEGF)。VEGF通路异常会引起新的渗漏血管生长并导致液体在视网膜中积聚。
目前,ABBV-RGX-314正处于3期临床开发阶段,RGX-314通过眼部不同给药途径的临床研究正在有序推进中。
结语
回顾这一领域的总体发展趋势,我们可以清晰地看到,无论是细胞疗法还是基因疗法领域都呈现出丰富而多元的技术发展局面。众多全球领先的医药企业已在这两个领域投入大量的研发力量,通过探索多种治疗方法和技术路径来应对各种疾病,这无疑印证了细胞和基因疗法领域不仅拥有巨大的商业潜力,更满足了现实中对多元化治疗方案的迫切需求。
正如Sonoma Biotherapeutics的首席执行官Jeffrey Bluestone博士在药明康德举办的全球论坛活动中所言,“我认为细胞和基因疗法将引领潮流。如果取得成功,我们将为重病患者开发出终身治疗方案,以及能够长久治疗甚至治愈的疗法。”

展望未来,我们期待将见证更多临床试验取得成功,更多创新产品获批上市,以及更多患者从中受益。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。