基因治疗中的AAV载体:质量检测及结构优化
腺相关病毒(AAV)是目前应用最为广泛且最为重要的体内基因治疗递送载体。它们可以递送高达4.7kb的遗传负载,并能广泛感染各种细胞类型,而且几乎没有致病性。AAV的生产过程以构建质粒为起始,到包装成病毒颗粒结束(图1)。由于AAV基因组的结构特征,制备具有高保真DNA的AAV病毒是很困难的。基于此,安升达提供一站式的AAV基因组测序质检方案,优化AAV载体的质量。
下图展示了基因治疗的重组AAV的生产过程。将目的基因克隆到AAV载体中,生成重组AAV质粒,然后将其导入真核细胞系。生成功能性病毒颗粒需要与Rep/Cap和辅助质粒共转染。最终重组单链DNA,包含目的基因及基因两侧的两个反向末端重复序列(ITR),被包装在AAV病毒衣壳中。ITR形成非常稳定的发夹状结构,这对AAV质粒的复制和基因组测序是有阻碍的。
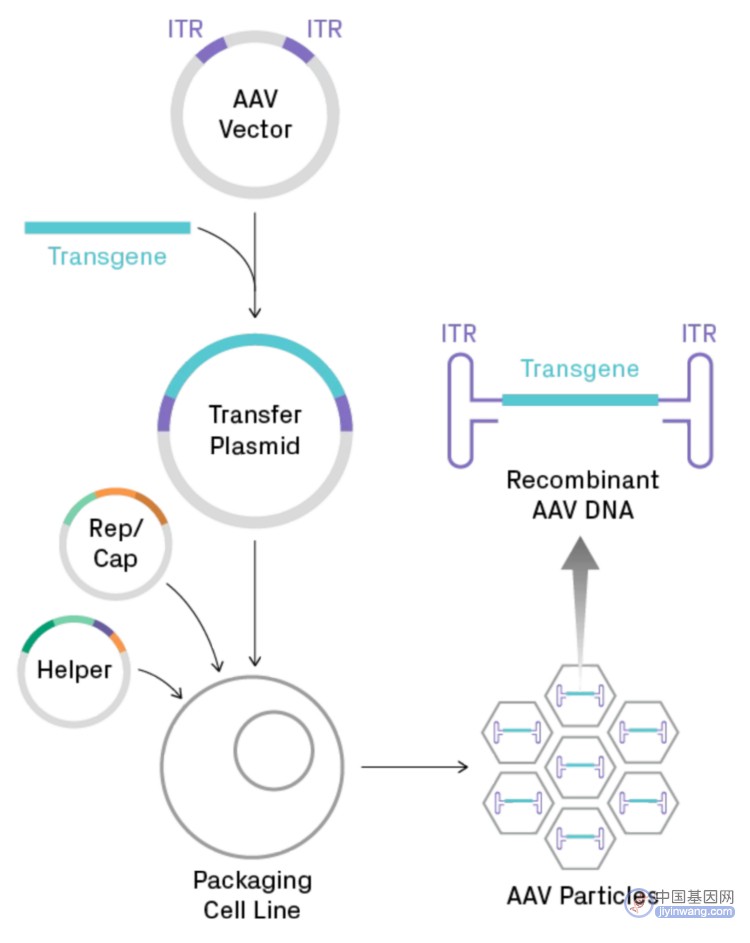
图1. 用于基因治疗的重组AAV的生产过程
AAV载体ITR区域的验证
AAV基因组结构中的反向末端重复序列(ITR)对于克隆来说是非常麻烦的,这些结构通常有145个碱基,位于目的基因两侧,在单链AAV基因组中会形成巨大的发夹状结构(图1)。由于ITRs中GC含量高,且具有回文性质,AAV质粒容易发生自发突变。当质粒在细菌中复制时,ITR区域经常发生截断。
因此,在使用AAV质粒时,序列验证是非常关键的。及时发现并纠正突变可以节省大量的时间和资源,如果不能在AAV病毒包装前发现ITR截断将会严重影响下游实验。为了保证实验的顺利进行,在克隆AAV载体之前以及在引入目的基因后最终制备重组载体时,都需要检查ITR的完整性。
Sanger测序作为检测质粒序列的金标准,可以对AAV质粒的序列进行验证。然而,常规的Sanger测序无法准确地读取ITR区域,ITR的二级结构会阻碍DNA聚合酶导致信号中断,测序失败。即使是采用常见的困难模板测序方案,比如添加DMSO或甜菜碱也是无效的。安升达专门为AAV质粒开发的了AAV-ITR Sanger测序方案,提供了最可靠的ITR验证方法。它可以读取整个ITR序列,能够确认结构的完整性和单克隆性。
常规测序
安升达 AAV-ITR测序
制备高保真AAV质粒
如前所述,ITR序列是高度不稳定的。ITR序列的丢失会使细菌在培养中获得生长优势,导致突变的频率迅速增加。因此,构建具有完整ITR区域的AAV质粒是一个重要挑战。
优化AAV质粒制备可以采取两种措施。第一种是在DNA制备后使用一种足够精确灵敏的检测方法来检测突变,即AAV- ITR Sanger测序。第二种是使用一种保持ITR完整性的菌株。重组缺陷菌株将有助于减少突变的频率,但分子克隆中常用的菌株仍不足以满足许多AAV结构。安升达开发了一套针对rAAV质粒构建、错误ITR的修复和rAAV质粒大量制备的方法——Hi-Fi技术,该方法的核心点不仅仅是制定了更简单、灵活和快速的克隆方案,而更重要的是发明了一种特殊的大肠杆菌细胞及其配套使用的AAV稳定剂,较现有的方法更能使rAAV质粒的ITR在细菌中扩增过程中保持稳定,不易再发生缺失。
技术流程
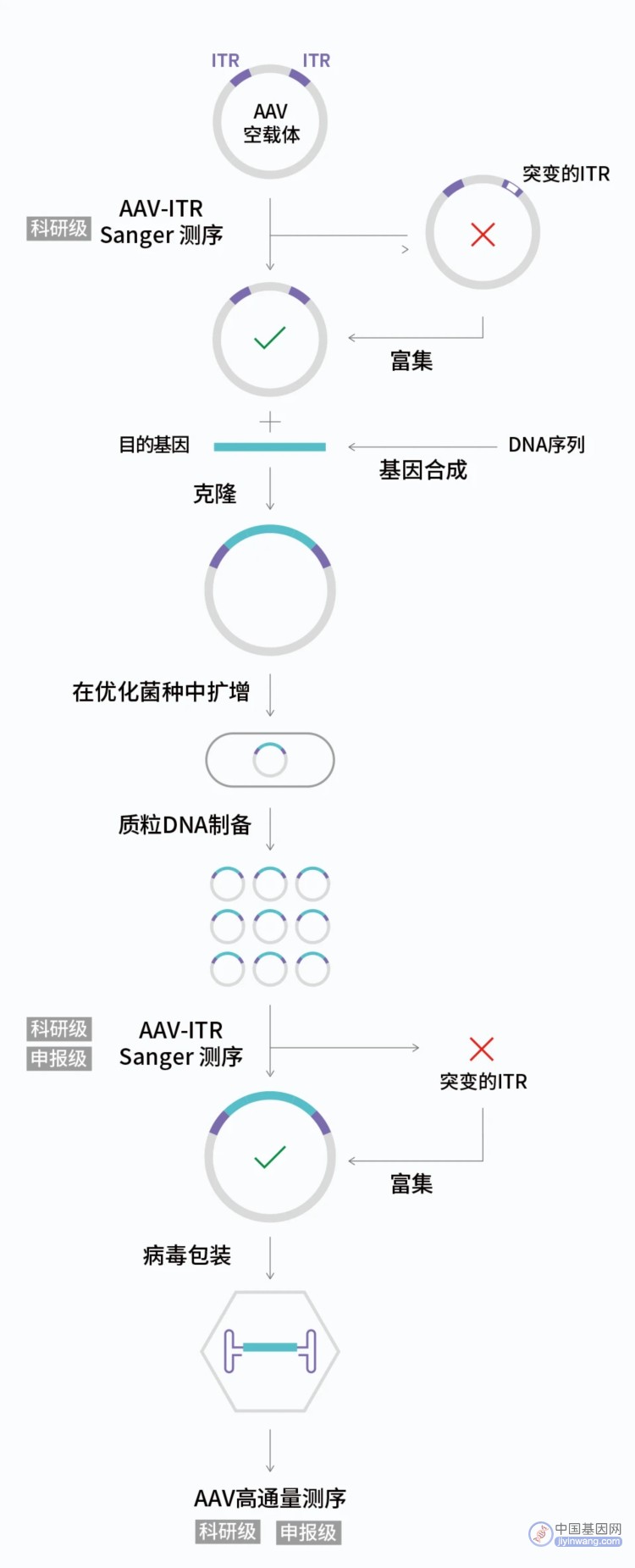
图2.AAV构建和验证的优化工作流程。基于测序的质量控制(QC)在AAV构建的多个阶段执行。利用Sanger测序分析AAV质粒的原始库,检测AAV-ITR准确性,确定是否为单克隆。如果在初始QC后检测到突变,则可采取纠正措施。合成基因序列并验证,克隆到AAV载体。所得到的质粒在经过ITR稳定性优化的专用大肠杆菌菌株中复制。重组AAV质粒制备通过AAV-ITR测序验证,然后引入包装细胞系。包装好的DNA产物通过NGS测序进行分析。安升达在部分工作流程可提供科研级及合规级两种不同级别的服务。
验证包装在AAV颗粒中的DNA
重组质粒构建和验证之后,将与辅助质粒和Rep/Cap质粒一起转染到包装细胞系中。这一阶段的目标是将单链重组AAV基因组的拷贝插入功能病毒颗粒中。然而,污染的DNA和突变序列也可能会被包装进去,这可能会影响基因治疗的安全性和有效性。污染序列可能来源于质粒骨架、Rep/Cap质粒、辅助质粒或宿主细胞。
因此,对包装产物的分析是质量控制所必需的。通过二代或三代测序是检测包装DNA纯度、同质性和保真度的最佳方法。二代或三代测序都可以提供有价值的信息,互为补充。
使用Illumina® 短读长测序,文库准备过程中包装的DNA产物被碎片化和扩增。高深度测序能够对样本中的所有DNA进行高度灵敏和精确的量化。将测序数据进行比对,就可以获得重组AAV基因组的reads的比例,污染物的来源和频率,以及AAV基因组突变的频率。
PacBio® 长读长测序的主要优势是DNA产物在文库构建时不会被打断,通过长度长测序能够获得DNA的完整连续序列,从而分析ITR区域以及AAV完整性和变异情况。
这两种方法都能够提供有价值的信息,互为补充,建议同时使用这两种方法来获得包装产品的全貌表征。
在临床前和临床研究中验证AAV
随着基因疗法进入临床前和临床阶段,严谨性和可重复性是必不可少的。在动物以及最终在患者身上进行的安全性和有效性研究需要严格遵守法规和文件。基于AAV的基因疗法用于制造最终产品的成分应该准确的质量检测。这包括AAV重组载体、包装细胞系和包装病毒DNA的序列确认。在准备FDA提交的数据(如IND、NDA和BLA申请)时,推荐使用安升达新推出的药企合规服务级别的AAV测序来验证完整的AAV序列,包括ITR区域。
总结
重组AAV基因组的ITR序列是病毒功能所必需的,但在实验室面临重大挑战。在整个过程中需要多个质量控制步骤,以确保AAV结构不会产生影响下游安全性或有效性的突变。安升达提供多种服务保障整个AAV结构的可靠测序以及重组载体的高保真性。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。