定价动辄数百万美元的基因疗法,基因公司打算如何销售?
导语:从诺华210万美元的Zolgensma,到蓝鸟生物280万美元的Zolgensma和300万美元的Skysona,再到CSL Behring 350万美元的Hemgenix,我们惊叹于不断刷新的“全球最贵药物”纪录的同时,也不由得开始怀疑,这么昂贵的药物到底要怎么才能卖出去呢?
2022年8月17日,美国FDA宣布,批准蓝鸟生物(Bluebird bio)开发的用于治疗β-地中海贫血的基因疗法Zynteglo上市,定价280万美元,一举超越此前诺华(Novartis)针对脊髓性肌萎缩症(Spinal muscular atrophy,SMA)儿童患者的一次性基因疗法Zolgensma 210万美元的定价,成为全球最贵药物。
然而,时间还没过去一个月,蓝鸟生物又推出了其第二款用于治疗4至17岁男孩罕见的神经系统疾病脑型肾上腺脑白质营养不良(Cerebral adrenoleukodystrophy,CALD)的基因疗法药物Skysona,定价300万美元,超越Zynteglo,成为史上最贵药物。11月22日,FDA再次宣布,澳大利亚制药公司治疗B型血友病的一次性基因疗法Hemgenix获批,定价350万美元,又一次打破了价格纪录。不到半年的时间,“全球最贵药物”已三易其主。
值得注意的是,或许也可以说情理之中的是,这几款天价药物均为基因治疗产品。这种疗法意味着患者能够获得外源的正常基因,纠正或补偿自身体内缺陷、变异基因引起的疾病,达到一次性从根源上彻底治愈的效果。就以Zynteglo针对的β-地中海贫血来说,如不采用基因疗法根治,患者就需要终生身输血和去铁治疗,按蓝鸟生物的估计,患者一生中治疗和相关护理的费用将超过600万美元;而Zolgensma针对的SMA患者,之前救命药诺西那生钠注射液国内价格曾高达70万元/针,美国的定价则是单支12.5万美元,需要首年打6针,其后每年打3针。因此,从长远来看,基因疗法的价格虽然昂贵,但对于患者仍具有一定的经济效益。
其次,这些基因疗法针对的都是罕见病甚至是超罕见病,这就意味着这些疗法本身的受众群体注定十分有限,而最终接受治疗的患者则更少。以Zynteglo为例,蓝鸟生物估计,在美国约有1500名依赖输血的β-地中海贫血患者,而其中可能有800至850名患者的健康状况足以接受Zynteglo,在这之中,蓝鸟生物的首席商业和运营官Tom Klima估计,大约三分之一的人对基因疗法抱有尝试的意愿并可能考虑Zynteglo,另外三分之一可能会观望,剩下的则对基因治疗缺乏需求和兴趣。
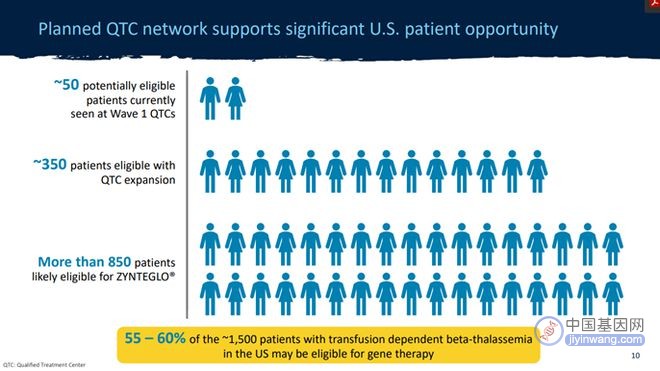
图1 蓝鸟生物估计的Zynteglo患者人数(图源:蓝鸟生物官网)
而基因疗法不仅研发投入漫长而复杂,其生产制造以及应用到患者身上,其中涉及的成本也都十分高昂。当一名患者开始Zynteglo治疗,首先需要在蓝鸟公司授予资质的治疗中心(Qualified Treatment Centers,QTCs)处采集自身细胞,然后这些细胞将会运往CMO的工厂,进行基因改造,之后再运回QTC输回患者体内,整个生产和交付过程需要70至90天的时间。这就导致了药企必须设定极高的价格分摊到为数不多的患者头上,来保证公司此前的投入有所回报,不至于是打了水漂。
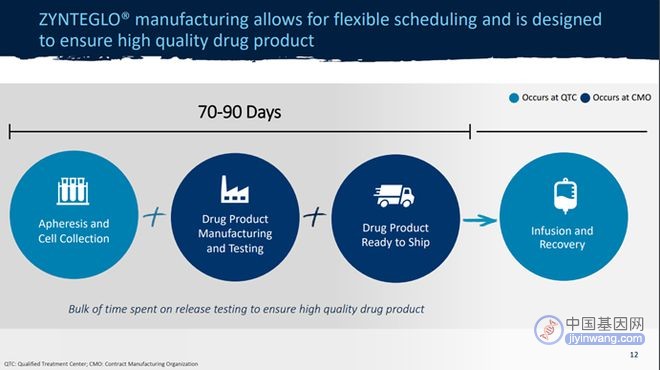
图2 Zynteglo生产和交付过程(图源:蓝鸟生物官网)
但在高价上的坚持也让蓝鸟生物付出了代价。事实上,Zynteglo和Skysona在美国上市之前就分别早在2019年5月和2021年7月在欧盟获批上市,然而两者在欧洲的商业化都以失败告终:Zynteglo2021年4月宣布从德国撤市,随后又宣布将在2022年初更广泛地撤出欧洲市场;Skysona则上市不到三个月,就宣布由于商业策略原因退出欧洲市场,放弃欧洲药品管理局(European Medicines Agency,EMA)和英国药监局(Medicines and healthcare products regulatory agency,MHRA)对Skysona的监管批准,其根本都与价格难以谈拢有关。
据STAT News发布的报告显示,关于Zynteglo德国政府给出的方案是,在2020年11月至2022年9月期间,每位患者可以支付的初始价格是79万美元,如果后续证实患者确实在治疗中收益,不再依赖输血治疗,那么德国政府将会补偿性地把价格提升到每人95万美元,但蓝鸟生物对Zynteglo给出的定价是157.5万欧元(约180万美元),并可在五年内分期支付。
蓝鸟生物现任总裁兼CEO、时任严重遗传病负责人的Andrew Obenshain评价德国政府在谈判中竭尽全力,“不只是为了拿到一个最低价,也是想为未来所有基因疗法的定价给出一个先例。”但蓝鸟生物方面也抱有相同的心思,尤其是当公司还存着打开更大的镰状细胞病市场的计划。“接受他们的价格,开启这个先例,对于基因疗法的创新是十分不利的。”Obenshain说。

图3 Andrew Obenshain(图源:蓝鸟生物官网)
那么,在将重点转向美国市场之后,Zynteglo和Skysona的命运是否将迎来转折?
不同于中国和欧洲一些国家医保基金由政府统筹管理的全民医保制度,美国医疗保障主要通过企业为员工向商业保险公司购买医保。在此基础上,商业保险公司为了降低支出,美国还发展出了一种药品福利管理(Pharmacy Benefit Management,PBM)体系,由介于患者、医院、药房、制药商和保险公司之间的第三方组织进行协调,审核医生开具的处方,监管医疗服务过程,同时也利用自身用户规模效应对制药商和药房形成较高的议价权,帮助制药商、药房打开销售渠道,也大幅降低保险公司的保费支出。因此,蓝鸟生物在美国的生死,将由商业保险公司和PBM企业来决定。
事情似乎发展得还算顺利。8月Zynteglo刚获批时,蓝鸟生物表示,正在与保险公司及国家药品福利经理就Zynteglo的承保范围进行深入谈判,“已经从付款人那里得到了对定价思路的积极反馈。”Klima说。而在11月7日公布的2022年第三季度财务业绩报告中,蓝鸟生物表示,已经有27名患者开始进行福利验证,核实他们是否在保险范围内,其中大约三分之一的人已经获得了“事先授权”(Prior authorization),这表示保险公司综合考虑患者年龄、医疗必要性、是否有替代药物等因素后,同意对该医疗程序的费用进行覆盖。蓝鸟生物估计,虽然不是所有的患者都会接受治疗,但这是存在较大需求人群的利好信号。但考虑到患者需要完成同意流程、福利验证和事先授权等手续,预计要到今年年底,才能开始第一位患者治疗的第一步,细胞采集。
第三季度财报还指出,蓝鸟生物在构建QTC网络的过程中,还收到了计划外的30多家成人和儿科机构的入站请求,这表明还有尚未被满足的治疗需求。此外,蓝鸟生物已经与代表40多个国家和地区计划的药品福利经理(Pharmacy benefit managers)签署了基于结果的协议,已有12家付款人发布了与Zynteglo临床证据基础一致的医疗保险政策。
另外在支付方式上,蓝鸟生物也推出了一种新的“无效退款”模式:如果患者病情没有好转到能够摆脱持续的输血,那么将会退款80%,而Zynteglo III期试验的结果表明,90%的患者不再需要输血。不过,蓝鸟生物也曾明确表示,Skysona和Zynteglo不同,CALD的罕见性和复杂性使得这种基于治疗效果的付款模式难以实施。
未来,Zynteglo和Skysona在美国的销售情况会如何演变,以及之后蓝鸟生物的镰状细胞病基因疗法能否在此基础上能够顺利进展,值得持续关注。这不仅关系到蓝鸟生物能否挺过资金短缺的危机,也代表着其他天价基因疗法在商业化过程中可能面临的命运。
参考资料:
[1]https://www.biopharmadive.com/news/bluebird-zynteglo-launch-gene-therapy-insurance-coverage/638484/
[2]https://investor.bluebirdbio.com/news-releases/news-release-details/bluebird-bio-reports-third-quarter-2022-financial-results-and
[3]http://www.acla.org.cn/article/page/detailById/29991
[4]https://db.dxy.cn/yyzx/1775763.html
[5]https://www.fiercepharma.com/pharma/3m-gene-therapy-bluebird-breaks-own-record-fda-approval-skysona
[6]https://www.biopharmadive.com/news/bluebird-bio-gene-therapy-price-zynteglo-million/629967/
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。