NBT:陈斯迪团队开发密集平行基因敲入技术并筛选出细胞治疗新基因
细胞疗法开启了⼈类癌症免疫治疗的新时代,使癌症治愈变成了可能。近年来获批上市的CAR-T疗法是采集病⼈⾃身的T细胞,在体外利用基因重组进行改造成表达嵌合抗原受体(Chimeric Antigen Receptor, CAR)的新T细胞,使之能特异地识别攻击病⼈体内的癌细胞。迄今,已有六款CAR-T疗法近年获得FDA批准上市⽤于治疗B细胞⽩⾎病/淋巴瘤和多发性骨髓瘤,但目前还没有CAR-T细胞疗法被批准用于实体瘤的治疗中。因此以快速高效的筛选办法去克服目前CAR-T细胞在实体瘤中所面临的瓶颈问题是很重要的一个研究方向。但由于原代T细胞有限的自我复制能力以及自身的免疫排斥特性,对细胞做精准大量的基因修饰极具挑战。目前,基于T细胞的筛选方法主要依赖于用慢病毒将文库递送到T细胞的基因组, 因此存在插入诱变和翻译沉默的风险,并且想同时呈递转基因或嵌合抗原受体(CAR)更是极大的挑战。目前领域中精准定点基因敲入依赖于以电转Cas9 蛋白-RNA复合物(RNP)和双链或单链DNA (dsDNA/ssDNA)模版。这种编辑方法会产生严重的细胞毒性而限制了其在细胞中基因文库敲入的效率和规模,并且目前这种基因筛选方法通常一次只能做单一的修饰,因此想要从多方面提升细胞的功能,开发新型细胞基因修饰技术势在必行。
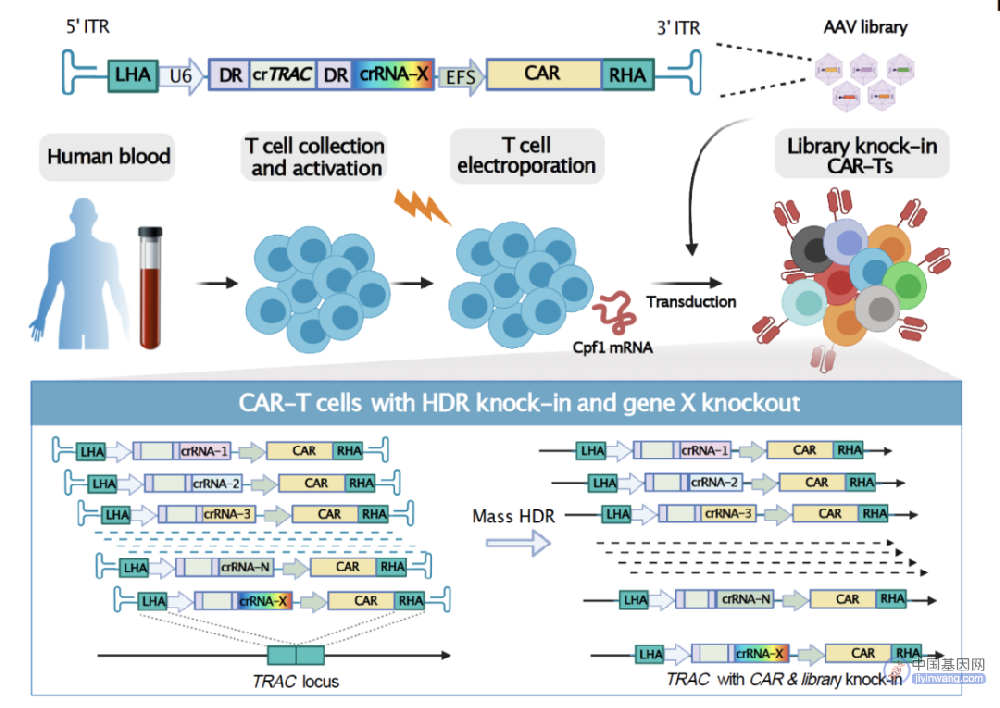
2023年1月26日,来自于耶鲁⼤学陈斯迪 (Sidi Chen)教授实验室在Nature Biotechnology杂志发表了题为Massively parallel knock-in engineering of human T cells的⽂章,描述了实验室最新研发的基因编辑与腺相关病毒库介导密集平行同源重组基因敲入 (简称 密集平行基因敲入,英文简称CLASH)技术。这项新技术结合了信使核糖核酸(mRNA)与及腺相关病毒(Adeno-Associated Virus,AAV)文库。mRNA编码CRISPR Cpf1/Cas12a剪切酶,而AAV文库编码大量同源重组(HDR)模版投递特定的基因片段或者编辑修饰。CLASH (CRISPR-based library-scale AAV perturbation with simultaneous HDR knock-in)技术使得对细胞进行大规模长链转基因精准敲入变成可能。CLASH比目前常用的以DNA为模版做长链转基因敲入的方法毒性更低,文库量更大且灵活性更高。CLASH原理上能应用于多种人类细胞,使得细胞治疗候选药物的发现与筛选得以加速。

该研究利用CLASH技术建立了新型人体T细胞大规模定向敲入和筛选文库 CLASH在利⽤AAV编码crRNA array递送CRISRP/Cpf1 crRNA 文库的同时,同时将CAR 转基因定向敲入到人类T细胞的TRAC 基因位点,消除了T细胞本身内源性TCR基因在筛选中的干扰。作者运用CLASH 在多个细胞治疗靶点和模型,包括体外长周期培养 血液癌和实体瘤动物模型中 进行了大规模筛选 充分的证实了该方法的高效性和准确性。这些CLASH筛选发现了一批可调控CAR-T细胞持久性和肿瘤穿透力的潜在新基因。通过时间序列分析模型 (SAMBA 桑巴算法),对CRISPR Cpf1/Cas12a crRNA的高通量测序结果进行富集分析。在SAMBA分析的筛选结果中,不仅发现了已在临床被发现和证实可提高CAR-T持久性的TET2基因,也发现了许多新的潜在靶点,包括PRDM1, JADE1, PELI1, EHMT1, KDM4E和NLRP10等。这些结果显示出了CLASH 强大且无偏好性地对CAR-T 突变体进行筛选的能力。
在后续实验中 作者证明这些基因有成为CAR-T细胞疗法通用增强元素(Universal CAR-T modification)的潜力。结合多种CAR-T动物肿瘤模型 作者发现这些基因的编辑能使得各种靶点和疾病相对应的CAR-T细胞疗法都能得到显著提高 包括CD19和CD22靶向的血液癌CAR-T和 HER2靶向的实体瘤CAR-T。在研究中作者还发现了一个独特的 CRISPR crRNA 可使 PRDM1 基因发生选择性剪切(Alternative Splicing)而产生特异性外显子 3 跳跃的突变体 (PRDM1 Δexon3)。通过肽段点阵分析发现该突变体破坏了PRDM1蛋白的PR domain,而使得PRDM1丧失了与组蛋白H4的结合从而失去了调控下游基因的能力。而且作者利用新型染色质免疫共沉淀测序方法(Cut and Run)结合转录组分析方法,从全基因组层面揭示了PRDM1 Δexon3 CAR-Ts的直接调控机制。PRDM1 Δexon3 CAR-Ts 不仅显示出了T细胞干性, 且具有更强的细胞增殖能力,因此在多个体内模型当中都展现出了更好的抗肿瘤能力和在体内的持久性。
本研究侧重于首次建立密集平行基因敲入CLASH 技术并利用与CAR-T 细胞做基因突变体的筛选 从而快速发现提高细胞治疗效果的通用增强元素。本研究在T细胞上的应用上证明 了CLASH 的可行性、高效性和灵活性。CLASH还具更广泛的应用:1)CLASH 可做全基因组的单基因甚至双基因的敲除或激活筛选;2)使用不同整合位点可以实现新式筛选调控;3)使用新的AAV载体基础元件可以实现TCR repertoire 文库或其他合成库做大规模的点突变或者转基因筛选;4)通过适当的优化和调整,CLASH原则上还可以应用于许多其他的细胞种类,包括其他免疫细胞、干细胞或来自其他物种的细胞。总而言之CLASH有望为细胞治疗或其他细胞和基因的基础研究提供更强大的新手段和新思路。
该研究由陈斯迪组的代晓云博士主导,协同 Jonathan Park 博士, 杜雅莹博士, Staley Lam和Sarah Slavoff 组的那振坤博士等 共同完成。
原文链接:https://doi.org/10.1038/s41587-022-01639-x
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。