里程碑!全球首个体内基因编辑疗法获批开展III期临床
10月18日,Intellia Therapeutics宣布FDA已批准其体内CRISPR基因编辑疗法NTLA-2001开展关键III期临床,预计今年年底启动。NTLA-2001是全球进展最快的体内CRISPR基因编辑疗法,用于治疗甲状腺素转运蛋白淀粉样变性(transthyretin amyloidosis,ATTR淀粉样变性)。
此前Intellia已与Regeneron(再生元)达成协议,Intellia将主导NTLA-2001的开发和商业化,Regeneron将承担25%的成本,以换取相同的利润份额。
NTLA-2001的前期数据
ATTR淀粉样变性是一种危及生命的罕见病,其特征是错误折叠的转甲状腺素(TTR)蛋白在组织(主要是神经和心脏)中进行性积累。NTLA-2001作为一种体内基因编辑疗法,可通过降低血清中TTR的浓度来治疗ATTR淀粉样变性。
NTLA-2001采用LNP肝脏递送系统,携带靶向人TTR基因的sgRNA和经过优化的化脓性链球菌Cas9蛋白的mRNA序列。NTLA-2001治疗ATTR淀粉样变性的作用机制如图1所示。
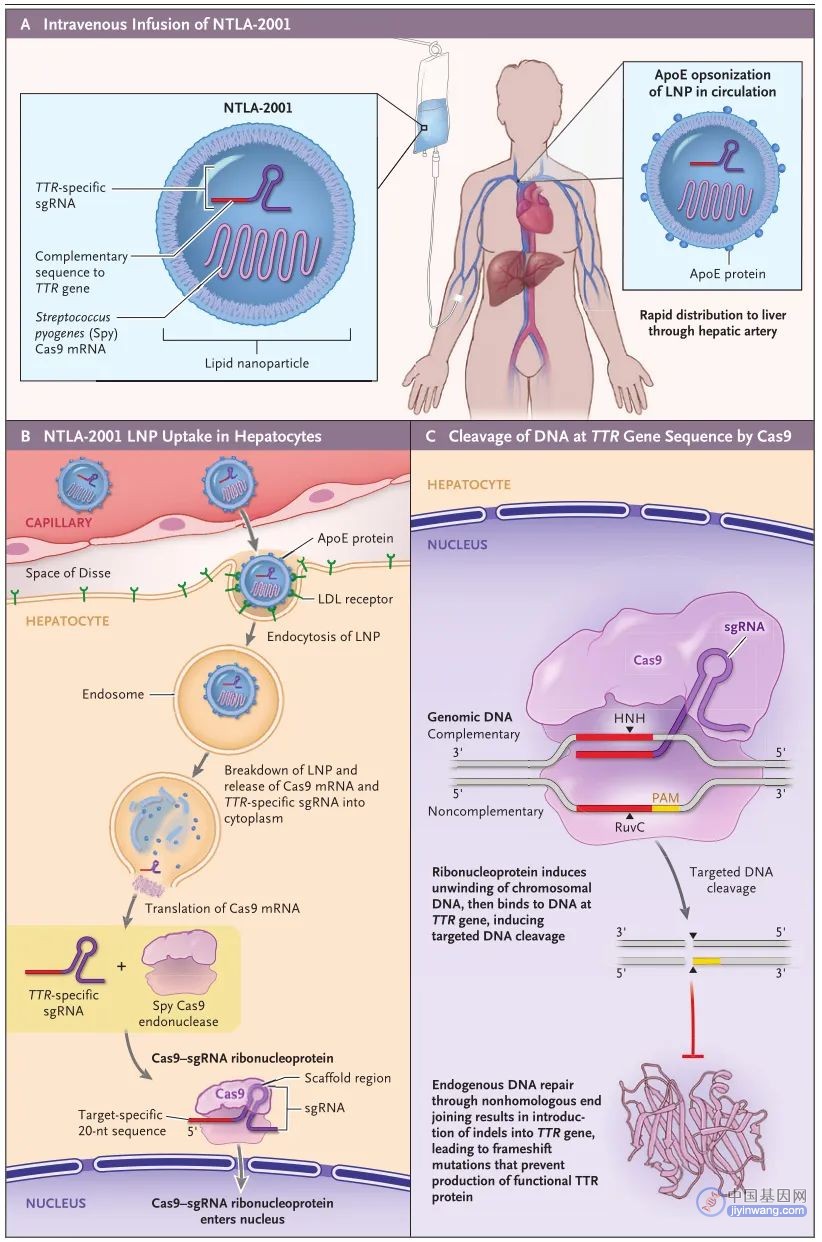
图1. NTLA-2001的作用机制(来源:N Engl J Med)
2021年6月,N Engl J Med发表了NTLA-2001的部分临床前数据和I期临床试验数据。
临床前数据方面,如图2所示,在原代人肝细胞中,低浓度NTLA-2001即可产生高水平的TTR编辑效率(≥93.7%),TTR mRNA表达减少91%+,TTR蛋白产生减少95%+。另外,测序结果显示,NTLA-2001能诱导TTR基因被敲除。
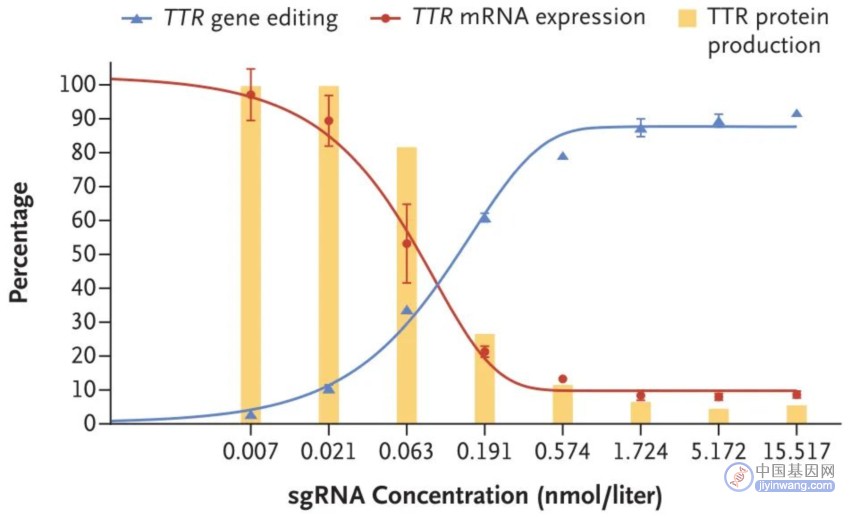
图2. NTLA-2001高效的体外编辑效率(来源:N Engl J Med)
另外,NTLA-2001在食蟹猴体内基因编辑的药效如图3所示,两组剂量下(3mg/kg,6mg/kg),血清TTR蛋白减少,并可维持12个月,测序结果也证实了NTLA-2001对TTR基因的编辑能力。
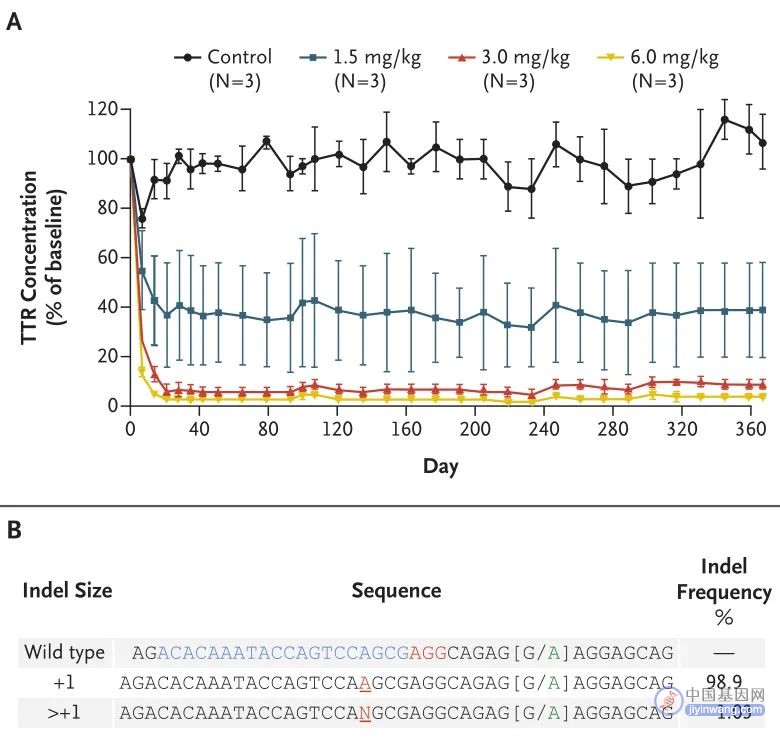
图3. NTLA-2001在食蟹猴体内基因编辑的效果(来源:N Engl J Med)
临床数据方面,此次I期临床试验评估了6例患者在单次递增剂量情况下的安全性和有效性,两个初始剂量组(0.1 mg / kg和0.3 mg / kg)各3例。研究结果如图4所示,经NTLA-2001治疗后,0.1mg/kg剂量组患者血清TTR下降52%,0.3mg/kg剂量组下降87%,两个剂量组患者耐受均良好,暂未出现严重不良事件和肝脏损害,该疗法显示出良好的有效性和安全性。
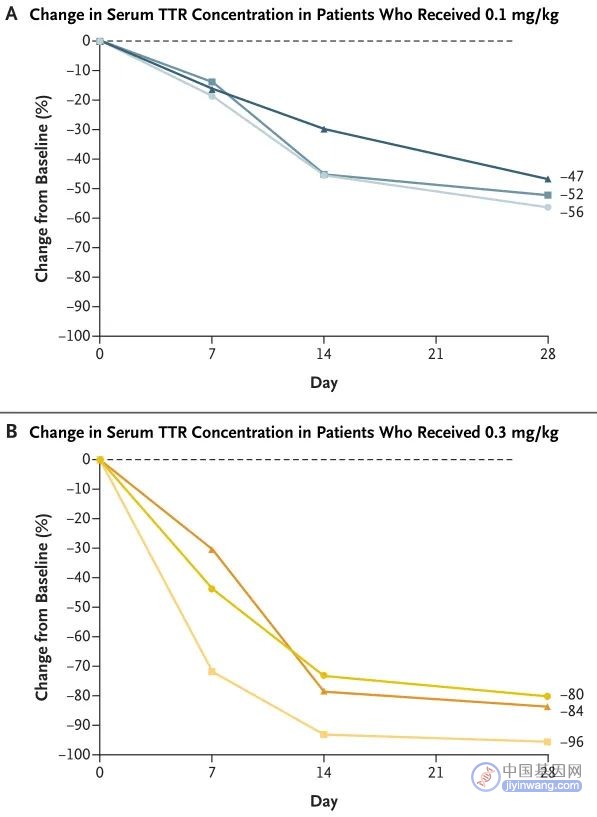
图4. 病人输注NTLA-2001后血清TTR蛋白浓度降低(来源:N Engl J Med)
此次Intellia的声明中并未披露NTLA-2001的III期试验设计细节,不过Intellia首席医疗官David Lebwohl博士曾在8月份的一次电话会议上表示,该研究的规模将与Alnylam的HELIOS-B研究“非常相似”(Alnylam在III期试验HELIOS-B中招募了655名ATTR淀粉样变性患者)。
Intellia和CRISPR
2020年,诺贝尔化学奖授予美国科学家Jennifer Doudna和法国科学家Emmanuelle Charpentier,以表彰她们在基因组编辑方法研究领域做出的贡献。这种基因编辑方法便是第三代基因编辑技术CRISPR/Cas技术。
基于对CRISPR技术的前期研究,Doudna于2014年创办了CRISPR/Cas9基因组编辑公司Intellia。2016年,Intellia在纳斯达克上市。
目前Intellia在体内/外CRISPR基因编辑方面拥有多条管线,其中进展最快的是NTLA-2001,即将进行III期临床试验。
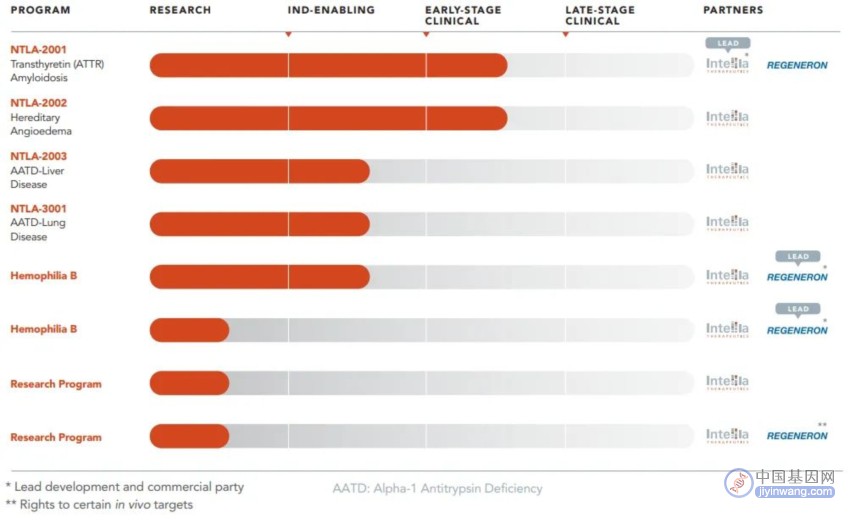
图5. 体内CRISPR基因编辑管线(来源:Intellia官网)
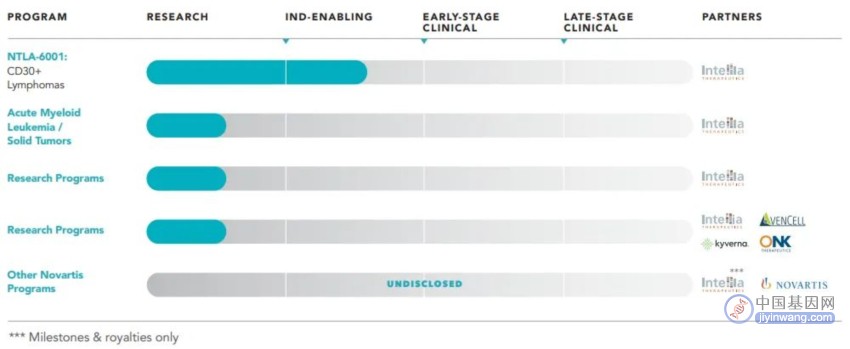
图6. 体外CRISPR基因编辑管线(来源:Intellia官网)
基因编辑有体内基因编辑和体外基因编辑两种,体内编辑基因疗法可使用LNP或LNP+AAV组合的形式,将基因编辑工具递送至体内。体内基因编辑将从根本上改变许多疾病的治疗方式,有望达到一次治疗终生有效的目标。
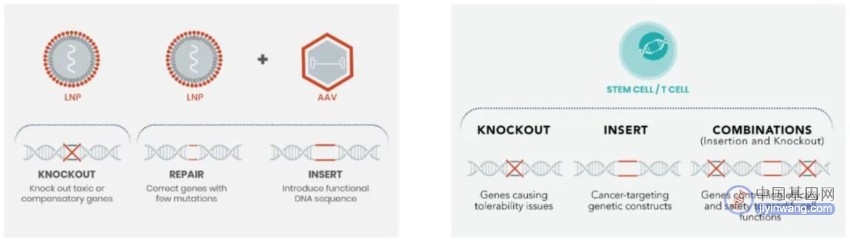
图7. 体内基因编辑和体外基因编辑(来源:Intellia官网)
此次Intellia获FDA批准NTLA-2001开展关键III期临床,意味着全球首个体内编辑疗法进入后期临床阶段,有望从根本上改变许多疾病的治疗方式。
参考资料:
[1]Julian D. Gillmore. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. The NEW ENGLAND JOURNAL of MEDICINE(2021)
[2]https://www.fiercebiotech.com/biotech/intellia-gets-fda-ok-trial-vivo-crispr-therapy-us-teeing-23-start-phase-3-trial
[3]https://www.intelliatx.com/
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。