裘依辰等开发“按需启动”新型特异基因疗法帮助治疗癫痫
癫痫主要的特征为自发和间歇性惊厥,过度活跃的脑回路是癫痫背后重要的发病机制。在传统药物治疗或手术治疗的过程中,药物可扩散至整个大脑,但不能够针对性治疗过度活跃的异常脑区,同时手术治疗只适用于一小部分患者,因此仍有三分之一的癫痫患者需忍受如惊厥等癫痫发作带来的严重影响。
过往的研究表明,不少神经系统疾病的发病过程中都可检出神经元过度活跃的标志基因,而癫痫发作的机制正是过度活跃的神经元导致了异常激活的脑回路,产生惊厥。近年来针对癫痫的基因疗法展示了调节过度活跃脑区可以有效控制自发性惊厥,但是这些疗法并不能够有效区分“健康”和“过度活跃”的神经元。
近日,伦敦大学学院神经病学研究学院,癫痫研究院的Kullmann和Lignani团队在Science杂志上发表了题为On-demand cell-autonomous gene therapy for brain circuit disorders的研究论文。针对以癫痫为例的脑回路活动性异常引起的疾病,研究团队研发了一种新型的基因疗法。该疗法运用于非遗传性的神经系统疾病并且有效的控制疾病的进程。与传统纠正错误基因序列的方式不同,这种新的基因疗法通过搭载功能基因来达到治疗效果。

该基因疗法可以自主识别过度活跃细胞,使搭载的功能基因能够只在这些被识别的细胞中表达、在正常活动细胞中不表达。在成功调节过度活跃细胞后,这种基因疗法便自主停止表达,形成闭环 ‘close –loop’。另外,这种基因疗法不需要额外的药物或光电仪器辅助控制,其本身就可以完成对过度活跃脑区的针对性的治疗,对靶向性治疗有一定的启发性。
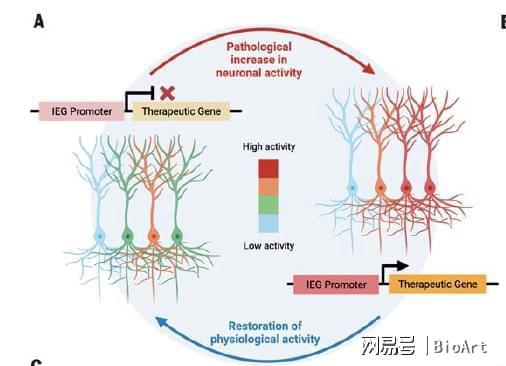
研究团队首先筛选了一系列对神经元刺激会产生反应并表达的基因,包括early immediate genes(例如cfos, Arc 和 egr1)。除了这些自然基因的启动子 (promoter),作者也测试了一些人工合成的启动子 (synthetic promoters,如ESARE, NPAS4-derived) 。这些启动子的共通性是通过感知胞内钙信号来引导基因表达,又称活性依赖启动子(activity-dependent promoter)。在以往的文献中,这种activity-dependent promoter 已经被广泛应用于标记活跃的神经元。
作者以腺相关病毒(AAV)作为载体,设计将这些启动子与钾离子通道基因连接形成不同组合进行测试。由于钾离子通道可通过调节离子平衡减少神经细胞活动,当设计的组合被成功启动表达时可进入‘switched-on‘状态,即启动被激活,介导下游的钾离子通道高表达,从而减弱神经元兴奋性。在体外培养的神经元中,作者测试了两种不同的钾离子通道,分别为KCNA1 (Kv1.1) 和KCNJ2 (Kir2.1)。首先在PTX (picrotoxin, GABA 受体阻断剂)激活的神经元中,作者证实启动子活化水平与神经元活动的变化同步增加,并在6 个小时后达到峰值。
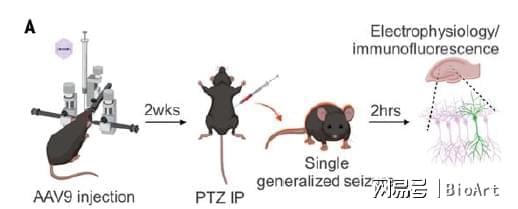
随后,作者进一步观察不同组合在PTZ (Pentylenetetrazol)诱发癫痫的小鼠模型中是否具有疗效。作者首先在小鼠海马脑区注射了AAV 搭载的promoter 与钾离子通道组合,接下来通过PTZ 注射诱导抽搐来诱发其在过度活跃细胞中的表达。作者发现其中cfos-KCNA1 组合再次表现最为出色。电生理实验结果显示,表达该组合的神经元的动作电位响应频率显著减弱(action potential frequency),同时阈值(current threshold)显著增高。此外,通过免疫荧光染色的方法,作者确认该组合主要表达在兴奋性神经元当中,而在GABA 阳性的抑制性神经元表达水平极低。由此,作者锁定cfos-KCNA1 为最佳组合。
为了测试cfos-KCNA1 组合是否能先在神经元活动异常的时候switch-on 并在钾离子作用下神经元活动恢复正常后switch-off,作者在两边的海马体中注射了AAV9 cfos-KCNA1 后,对已注射的小鼠进行了多次PTZ 急性诱导。作者推测第一次PTZ 诱导抽搐将会switch-on 该基因疗法,提高KCNA1 即钾离子通道的表达,在之后的诱导实验里抑制或减轻抽搐症状。24 小时后,作者第二次进行了PTZ 诱导并观察到,注射了cfos-KCNA1 的小鼠抽搐严重程度有所减轻,显示了该基因疗法成功控制了过度活跃神经元的活动并减弱了癫痫发作。
两周后,作者进行第三次PTZ 诱导并推测由于小鼠大脑并无过度活跃的活动,该基因疗法会switch-off,不再具有作用。作者观察发现在第三次PTZ 诱导实验中,注射了cfos-KCNA1 小鼠的发作严重程度和对照组之间无明显区别。这组实验证明了当有神经元过度活动的时候,该cfos-KCNA1 组合可被switch-on 并减轻抽搐严重程度;当脑部没有过度活跃神经元存在的时候,该组合switch-off,为闭环模型提供了有效证明。
最后,作者还在类人脑 (brain organoid) 模型中测试了该基因疗法。在这些成熟的类器官中,利用氯化钾(KCl)刺激模拟了高强度神经元活动来诱导基因疗法的表达。4 小时后,第二次添加了KCl 诱导高强度神经元活动,并观察到cfos-KCNA1 表达组的神经元整体活跃程度显著低于对照组。
以上实验结果证实,这项基因疗法在癫痫病理模型当中展现了良好的疗效,并且无可见副作用。这种活性依赖的基因疗法(activity-dependent gene therapy)通过使用活性依赖启动子(cfos-promoter)来控制钾离子(KCNA1) 的表达,并在小鼠慢性癫痫模型和人类干细胞诱导的类人脑模型当中取得了良好的成果。由于这种基因疗法是基于精准闭环控制过度活跃的神经元,与传统药物电击或手术治疗不同,具有良好的靶向性。从理论上来说,该疗法可以被推广到更多的神经系统性疾病,如帕金森,偏头疼等。同期Science发表了专项评述:Gene therapy for epilepsy。
裘依辰博士为第一作者,Dimitri Kullmann (FRS FMedSci MAE) 教授 与Gabriele Lignani 助理教授 为共同通讯作者。
http://doi.org/10.1126/science.abq6656
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。