协同进化的“春笋”体系,基信源科助推罕见病临床诊断进入全基因组时代
2023年5月7日,在上海张江举行的2023第七届未来医疗100强·百强峰会上,北京聚道科技有限公司(以下简称:聚道科技)与厦门基源医疗科技有限公司(以下简称:基信源科)重磅发布了“罕见病全基因组协同进化体系——‘春笋’ ”,为罕见病的临床全基因组诊断带来整体解决方案。
“春笋”将建立赋能医生的临床全基因组技术体系,降低TAT时间最快至20天以内,基于符合国内外临床标准的40X(120GB)/样本深度测序,结合院内数字化平台、大规模分布式计算和人工智能辅助决策技术,实现罕见病临床全基因组全面应用的 “破土生根”,惠及我国超5000万罕见病患者及其家庭。

聚道科技创始人兼CEO 李厦戎
全球超4.4亿罕见病患者,平均确诊经历7年以上,国内不足10%确诊
目前人类已知的罕见病超过7000种,其中约80%为遗传疾病。罕见病全球患者预计超过4.4亿,按人口比例估计,中国现存超过5000万罕见病患者。同时,在中国每年1000万新生儿中,5.6%会出现不同程度的出生缺陷(数据来源:国家出生缺陷办公室)。
可见,罕见病是一个严重影响全球人口的健康难题。从科研到临床,近年来对罕见病的关注正在飞速发展,根据沙利文数据显示,2021年,美国批准上市的50个新药中,有26个罕见疾病用药。
即便如此,在美国,罕见病患者平均要经历7.6年、8位医生、2-3次误诊,才最终确诊。在中国,42%的罕见病患者经历过误诊,5000万潜在患者中超90%的患者尚未得到确切诊断,反复四处求医给患者和家庭均带来极大的精神与经济压力。
因此,如何突破罕见病诊断效能瓶颈,成为目前罕见病领域最受关注的话题。
全基因组测序:临床最期盼的诊断技术,测序成本终于降至100美金
此前,罕见病临床诊断的检测方法包括染色体核型分析、荧光原位杂交、染色体芯片分析、Sanger测序、目标区域捕获测序、全外显子组测序等均不能同时满足对拷贝数变异、结构变异、线粒体DNA变异、编码与非编码区的单核苷酸变异和插入缺失等变异类型的检出,这就造成不能对遗传疾病致病原因的充分覆盖和诊断遗漏。因此,临床需要一种在基因区域、变异类型、疾病病种做到全面覆盖的检测技术。
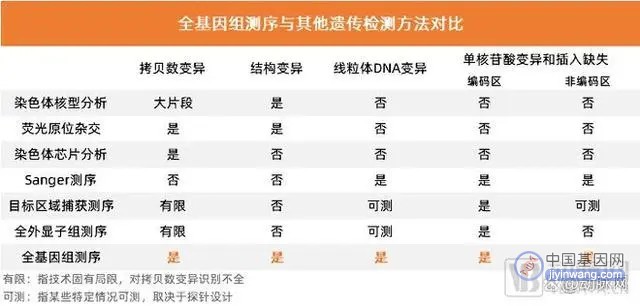
信息来源:上海交通大学医学院附属新华医院临床遗传中心执行主任余永国教授 的报告
通过以上表格对比,我们发现:全基因组测序(WGS)能够同时满足对上述全部变异类型的检测,在全基因组数据维度实现复杂变异与多组学的综合分析,几乎覆盖全场景和全病种的诊断需求,在检出率、均一性、GC含量影响、时间成本、操作步骤等方面表现出显著优势。
全基因组数据能提供标准数据与算法接口,易于进行高质量协作,并可持续拓展与代谢组和转录组等多组学综合分析的复杂变异泛化能力。因此,WGS已成为目前科研常用的技术手段。
截至目前,在NIH的PubMed数据库,应用全基因组测序技术发表的相关科研文章数目已经将近5.1万篇,也就是说,从2009年二代测序技术应用开始,平均每年有超过3600篇WGS相关文章发表,这些研究夯实了WGS临床应用基础。
既然医学界对WGS如此厚爱和期待,该技术在检出能力方面也得到了科研端的反复验证,为何该技术始终未在实际临床诊断中“大展拳脚”?
事实上,WGS也在持续“等待”机会——更低的测序成本。随着测序技术和智能分析的持续发展,全基因组测序的费用自2008年前后开始以“超摩尔定律”的速度不断下降。
National Human Genome Research Institute的数据显示,2001年,人类基因组测序成本高达9526.3万美元,2014年后基因测序成本基本稳定在了1000美元左右,2023年,华大智造发布了目前最高通量的DNBSEQ T20 X2测序仪,将全基因组测序成本从1000美元降低至100美元附近。
随着“100美元时代”的到来,以及全基因组分析算法的成熟与基因数据库的积累,全基因组测序的也终于敲响了其临床开展规模化应用的“大门”。
“春笋”罕见病全基因组体系的“厚积薄发”
成本下降后,中国全基因组测序的临床应用要如何落地?作为目前在基因层面的最高诊断等级,如何串联产业链、打造供应链?哪个领域可以成为全基因组测序在临床推广的合适选择?
罕见病全基因组协同进化体系——“春笋”,让行业找到了答案,让患者看到了希望。
目前聚道科技已经完成了4万例WGS样本的生信分析计算,不断打磨并优化覆盖全面的变异类型,累计数据量超过15PB,是目前成本最优、技术最可靠的组学云计算平台。医疗数字系统方面,聚道科技拥有目前最完备的临床遗传数字化系列产品,已经合作了包括华西医院、上海新华医院、复旦妇产科医院在内的国内超30家头部医院。
基信源科通过多年的临床遗传检测服务,汇集到了超百家医院的2万多罕见病病例,并整理了国内著名的罕见病临床知识库《基源黄宝书》,覆盖3万儿科医生。
在国内领先的医疗服务经验和组学数据技术的基础上,“春笋”很难不优秀。发布会介绍,目前“春笋”能够为超5000种罕见病提供40X、120GB/样本的深度测序,TAT时间<20天,平均每周可以支持超百例的样本检测,并提供全区域全变异类型的迭代分析,同时帮助患者链接MDT、遗传咨询、随访管理等诊疗资源,真正做到了技术、效率、性价比、实用性的多重兼备。
“春笋”通过链接散落在行业中的基因检测技术、数据/生信分析技术、前沿基因组学教授、各地区临床医生,以及罕见病患者,如“摆拼图”般将罕见病诊断涉及的技术与角色汇聚一堂,构建起完整的罕见病临床全基因组测序生态。
临床闭环落地难,“春笋”制定细分场景下的临床诊断策略,克服医疗水平参差
解决了技术、成本和产业链的问题,全基因测序想要在罕见病临床诊断中落地推广,还有一道大关要攻——临床医生对全基因组测序的标准化使用。
在我国,临床医生关于基因组学、遗传疾病理论的系统性教育相对缺乏,且对于本职工作已经十分繁重的临床医生来说,额外的培训学习也将带来更大的压力和成本。这是我国全基因组测序在市场普及中必须要解决的另一个难题问题。
“春笋”通过为不同临床场景下的医生定制不同的罕见病全基因组临床诊断流程,同时制定标准的操作规范并配套相应的智能辅助决策系统,减少了因为理论和经验水平参差带给诊断准确性的波动。
基于不同医疗条件设置的诊断流程,以及在遗传检测实验室、遗传专家等方面的优质资源,“春笋”将“医学遗传数据操作系统”和“高性能全基因组测序分析技术”相结合,最终实现了临床医生到遗传专家的高效临床协作闭环,彻底跑通全基因组测序在罕见病临床诊断的最后一公里。
通过基因技术帮助医生给患者带来平等的健康,“春笋”助推罕见病临床诊断
在过去的8年里,聚道科技和基信源科一直致力于研究遗传病和罕见病领域。他们专注于罕见病的原因不仅是因为罕见病市场的潜力和技术挑战,更是因为罕见病患者是基因技术临床应用的最主要受益者,而目前这些患者的长期临床需求尚未得到满足。
作为开拓者,“春笋”将遵循商业应用的底层逻辑,从应用场景的需求出发,通过整合复杂的供应链体系,把极简的标准化流程提供给医生和患者,从而更早触达和满足医患需求。
先天性的遗传问题让罕见病患者在出生时便丧失了平等的健康权,而“春笋”即是希望通过基因技术帮助医生给患者带来平等的健康。未来,不断协同进化的“春笋”体系将开拓更多有益于罕见病患者的医疗服务和技术方案。
1953年,DNA双螺旋结构发现。
2003年,人类基因组计划完成。
2023年,在分子生物学经历70年的积淀后,我们即将进入人人基因组时代。
“全基因组测序的临床应用对人类的影响一定大大超过我们现有的想象,20年前智能手机上市的时候一定不会想到,它竟然成了人们衣食住行不可分割的组成部分,改变了整个商业世界,也改变了对世界的认知。我想20年后一定有很多文献和报道纪念这个医学史上的重要时期,而我更想看到的,是当下受益于“春笋”的孩子,20年后和他的孩子们健康快乐生活的画面。”
—— 基信源科创始人兼CEO姚迅
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。