破解“血之诅咒”,血液疾病基因疗法展现长久效力
基因疗法和基因编辑疗法通过在患者体内长久表达治疗性基因或者永久改变基因组,有望通过一次性治疗,为患者带来长期疗效,甚至达到永久治愈的目标。然而,基因疗法和基因编辑疗法的疗效持久性仍然需要临床试验数据的验证。在正在举行的美国血液学会(ASH)年会上,多家公司公布了各自基因疗法和基因编辑疗法的最新临床试验数据。

部分患者不依赖输血长达54个月,bluebird bio基因疗法展现持久效力
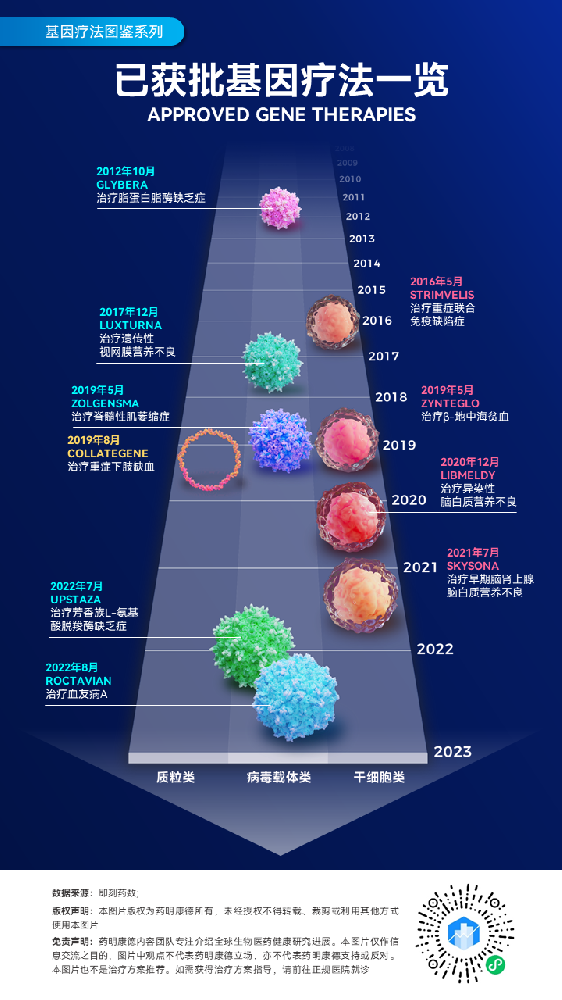
bluebird bio公司开发的基因疗法Zynteglo(betibeglogene autotemcel,beti-cel)今年8月获得美国FDA的批准,成为FDA批准的首款治疗严重β地中海贫血的基因疗法。在ASH年会上,该公司公布了Zynteglo的最新临床试验结果。截至2022年7月,63名接受治疗的患者中位随访时间达到52.0个月。在两项3期临床试验中接受治疗的患者中(n=41),90.2%(37/41)不再依赖输血。
在不依赖输血的患者中,所有患者在最近一次随访时仍然维持不依赖输血,其中有的患者维持不依赖输血的时间接近54个月。
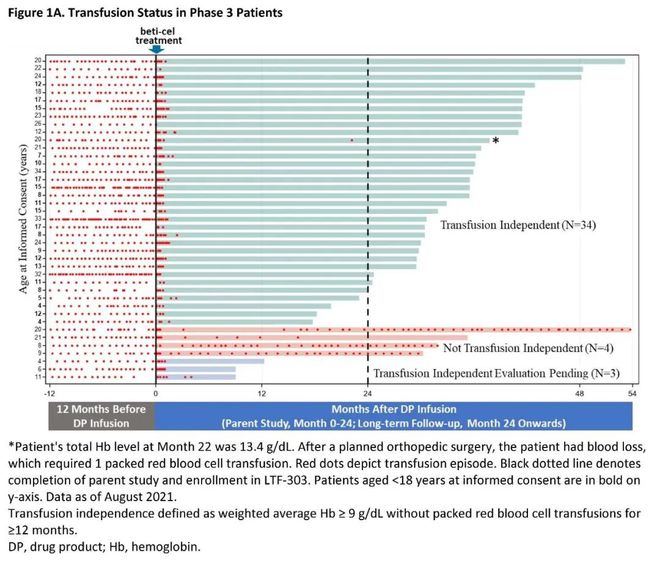
▲3期临床试验中接受治疗的患者的长期随访数据(图片来源:参考资料[5])
94%患者停止接受预防性治疗,血友病B基因疗法最新临床试验发布
CSL Behring公司在ASH年会上公布了与uniQure联合开发的血友病B基因疗法Hemgenix的最新临床试验结果。在名为HOPE-B的开放标签,单臂临床试验中,54名严重或中度严重血友病B患者接受了单剂Hemgenix的治疗。试验结果显示,在随访时间达到两年时,患者平均凝血因子IX的活性为36.7 IU/dL,与随访时间为18个月时的数值(36.9 IU/dL)相似。而且,94%的患者停止使用输注IX因子的预防性疗法。摘要显示,在接受治疗后19-24个月,与接受治疗前的基线相比,Hemgenix将每年因子IX使用量降低了96%。
超过90%患者持续表达凝血因子VIII,Spark公布血友病A基因疗法最新结果
罗氏旗下的Spark Therapeutics公司今日公布了在研血友病A疗法SPK-8011在1/2期临床试验中的多年随访结果。试验结果显示,截至2022年10月4日,91%(21/23)接受治疗的患者表现出持久的凝血因子VIII表达,其中两名参与者已经完成5年随访。在21名持久表达因子VIII的参与者中,包括所有出血类型的年出血率(ARB)降低92%(95% CI:78-97%)。此外,数据同时显示患者因子VIII使用量大幅度减少,接受基因疗法治疗后的每年因子VIII输注次数为0.3,接受治疗前为85.5。
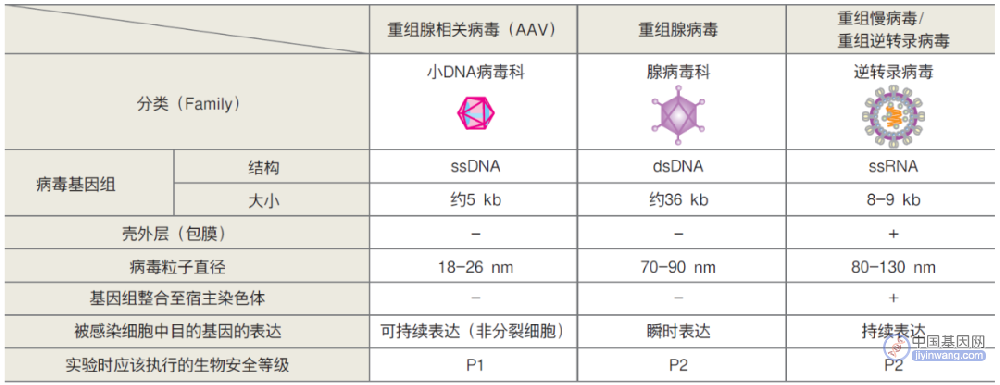
CRISPR基因编辑疗法展现“治愈”潜力
Vertex和CRISPR Therapeutics公司在ASH年会上汇报了基于CRISPR基因编辑技术开发的exagamglogene autotemcel(exa-cel)治疗输血依赖性β地中海贫血(TDT)和镰刀型细胞贫血病(SCD)患者的临床试验结果。结果显示,接受exa-cel治疗的44名患者中,42名维持不需要接受血红细胞输注。
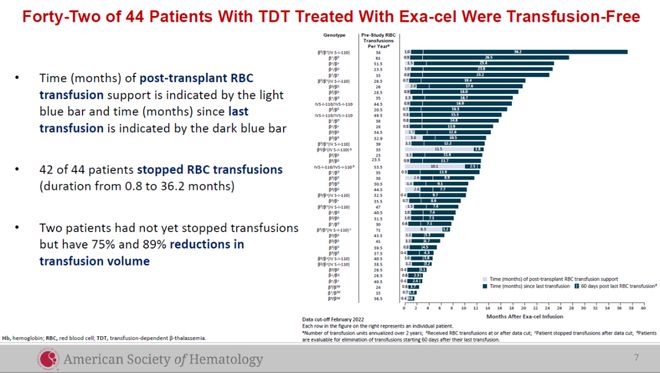
▲接受exa-cel治疗的TDT患者的临床试验数据(图片来源:CRISPR Therapeutics公司官网)
在接受exa-cel治疗的SCD患者中,所有患者均未出现SCD患者中常见的血管阻塞危象(VOC)。其中随访时间最长的患者已经维持32.3个月未出现VOC。
今年是血液疾病基因疗法“大爆发”的一年,血友病A,血友病B和β地中海贫血均迎来获得监管机构批准的基因疗法。Vertex和CRISPR Therapeutics公司开发的exa-cel有望在今年年底之前递交上市申请,向成为首款FDA批准的CRISPR基因编辑疗法迈出重要一步。期待更多基因疗法在这一领域研发顺利,解决患者未满足的医疗需求。
作为药明康德旗下专注于细胞和基因疗法的CTDMO,药明生基致力于加速和变革基因和细胞治疗及其他高端治疗的开发、测试、生产和商业化。药明生基能够助力全球客户将更多创新疗法早日推向市场,造福病患。如您有相关业务需求,欢迎点击下方图片填写具体信息。
参考资料:
[1] New Data from bluebird bio’s Gene Therapies for Transfusion-Dependent Beta-Thalassemia and Sickle Cell Disease Presented at 64th ASH Annual Meeting. Retrieved December 12, 2022, from https://investor.bluebirdbio.com/news-releases/news-release-details/new-data-bluebird-bios-gene-therapies-transfusion-dependent-beta
[2] Spark Therapeutics Announces Updated Phase 1/2 Study Results Supporting the Durability of Investigational Gene Therapy SPK-8011 in Patients With Hemophilia A. Retrieved December 12, 2022, from https://sparktx.com/press_releases/spark-therapeutics-announces-updated-phase-1-2-study-results-supporting-the-durability-of-investigational-gene-therapy-spk-8011-in-patients-with-hemophilia-a/
[3] CSL’s Novel Gene Therapy HEMGENIX® (etranacogene dezaparvovec-drlb) Demonstrates Durable Protection and Sustained Factor IX Activity Levels for People Living with Hemophilia B at 24-Months Post-Treatment. Retrieved December 12, 2022, from https://www.cslbehring.com/newsroom/2022/hemgenix-ash
[4] Efficacy and Safety of a Single Dose of Exagamglogene Autotemcel for Transfusion-Dependent β-Thalassemia and Severe Sickle Cell Disease. Retrieved December 12, 2022, from http://ir.crisprtx.com/static-files/7e00a1b8-667f-4254-8e45-4057c9a67493
[5] Long Term Outcomes of 63 Patients with Transfusion-Dependent β-Thalassemia (TDT) Followed up to 7 Years Post-Treatment with betibeglogene autotemcel (beti-cel) Gene Therapy and Exploratory Analysis of Predictors of Successful Treatment Outcomes in Phase 3 Trials. Retrieved December 12, 2022, from https://ash.confex.com/ash/2022/webprogram/Paper162400.html
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。