百万一针「治愈」癌症,普通患者如何用上细胞基因疗法?
一次给药,终身有效,功能性治愈癌症或血友病等罕见病,正是细胞与基因疗法(Cell and Gene Therapy, CGT)的“神奇”之处。近年,细胞与基因疗法赛道融资和交易频繁,BMS、强生、礼来等跨国药企纷纷通过收购公司或管线的方式进入。

在大洋彼岸的欧美市场,4月19日,细胞治疗公司传奇生物的一份捷报,为CGT行业注入一剂“强心针”,也令该公司股价当日大涨近20%。作为国内CGT企业出海的“扛把子”,传奇生物和强生共同开发的BCMA CAR-T产品Carvykti,去年在美国、欧洲、日本获批上市,定价46.5万美元(约合人民币310万元),上市一年便实现了2.06亿美元的销售额。
近日传奇生物公布的CAR-T疗法三期临床数据显示,Carvykti可以降低74%的疾病进展或死亡风险,这既意味着该产品有望用于更前线的多发性骨髓瘤治疗,也意味着在同类靶点的前线治疗中超越BMS的产品,坐上Best-in-Class的位置。
在国内市场,已上市产品的商业化却不尽人意,离收回研发注册成本仍有相当距离。药明巨诺、复星凯特的两款CAR-T产品2021年获批上市,药明巨诺的倍诺达定价129万/袋,去年共开出165张处方,营收1.46亿元;复星凯特则未公布奕凯达的销售数据,仅披露称已治疗近300位复发或难治性大B细胞淋巴瘤患者(截至2023年1月),该产品定价120万元/袋。
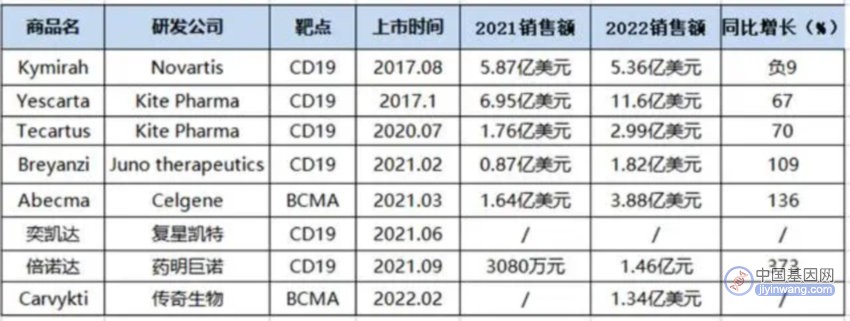
数据来源:药渡
细胞与基因治疗价格高昂,令患者“希望与绝望”并存。
自上市以来,CAR-T疗法的“可及性”问题始终困扰着行业与患者,在4月20日举办博鳌亚洲论坛健康产业国际论坛上,来自信念医药、纽福斯、北恒生物等公司的行业人士就CGT药品的医保分期支付、研发制造环节的国产替代、通用型产品技术突破等维度发表观点,探讨细胞与基因疗法“飞入寻常百姓家”的可能性。
支付端:呼吁医保分期支付,期待商保崛起
与海外多样化的支付环境相比,现阶段,国内仍以社会医保为主,商业健康险存量较低且正在快速增长中。经过历年的创新药医保谈判,医保方多次强调“保基本”的属性,因此行业中流传着创新药单价“50万以上不考虑,30万以上不入保”的隐性标准,而这一标准远低于CAR-T等细胞疗法产品的定价。
对此,信念医药联合创始人、董事长兼首席科学家肖啸认为,应考虑CGT产品的医保分期支付。具体而言,抗体药、小分子药一年需要多次用药,年报销额也有可能超过30万元。而对于细胞和基因治疗的药品,一次用药,就有望实现功能性治愈。因此其呼吁医保方面可对CGT产品的报销金额分摊至数年,在降低对医保冲击的同时,提高药品可及性。
事实上,对于医保端如何通过创新支付,覆盖造价高昂的细胞疗法等创新产品,行业内早有讨论。上海第一医学院公共卫生系胡善联教授曾在接受采访时表示,对于细胞与基因疗法等需一次性支付高额费用的先进疗法,年度分期付款可以解决问题,但需要有良好的信用系统、完善的税收制度和财产抵押支付。同时也建议“风险分担”的支付机制,对于临床效果没有达到预期的药品,企业需承担部分药费。
在支付端,除患者自费和社会医保外,商业健康险、惠民保、特药险等创新支付也被寄予厚望。据了解,CAT-T新药上市不到2月时,全国首例120万CAR-T药物便已通过医疗特药险完成了理赔,且是100%报销。另外,近期泰康人寿、太平人寿等多家保险公司宣布完成首例CAR-T治疗客户的理赔。在惠民保方面,山东“聊慧保”、上海“沪惠保”等惠民保产品中,也覆盖拓展了CAR-T特药的理赔。
现阶段,相比于社会医保、患者自付,在支付比例上,商业保险的占比较低,但“健康险年化增速24%,未来仍将保持20%以上的增长,”阳光融汇资本董事总经理李冰峰介绍道。他认为CAR-T产品,特别是针对CD19靶点的产品供给充裕,也存在相当大的需求,但支付不够导致供需缺口尚未弥补,此时商业保险应该发挥杠杆作用,将真正有临床价值的产品纳入商保,而惠民保、特药险、商业健康险等也确实愿意往这个方向走。
生产环节国产替代,降本保供
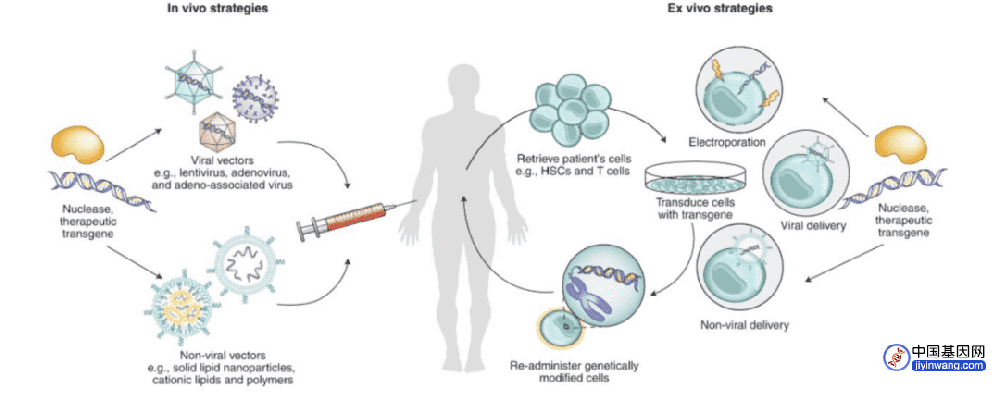
据了解,细胞疗法产品的生产成本或高达8-10万美元,海外终端价格普遍在30-40万美元左右;生产成本高、自体工艺导致制备周期长、且治疗疾病领域有限等多种因素,推高了细胞基因疗法的治疗费用。就CAR-T的制备流程而言,从采集患者自身T细胞,到分选、冷冻、激活、转导扩增、收获制剂,再到最终的输注,生产工艺复杂,往往需要3周左右时间。
在细胞与医疗治疗的生产过程中,用到多种仪器设备及耗材,既往供应链极度依赖进口。过去两三年间,受疫情、地缘政治等因素影响,CGT等生物医药生产制造上游的供应链也受到冲击,无论是从降低生产制造成本,还是保证供应链稳定的角度,“国产替代”成为多家企业主动探索的方向。
据信念医药联合创始人、董事长兼首席科学家肖啸介绍,目前公司约80%的原材料、设备仪器已是国产。对于大型仪器设备,若遭遇海外“卡脖子”政策,尚有回旋余地;而对于一次性袋子、生物反应器等等耗材而言,即便公司有一定储备,但一旦被“卡”,也可能显著影响研发进度。
国内基因治疗第一梯队企业纽福斯,其眼科罕见病基因治疗药物有望率先获批上市。在国产替代方面,其70%的原材料和器械设备仍选择进口,但现阶段纽福斯设置了专门的团队,就相关原料设备,对进口产品、国产产品进行质量比对,质量相同的便逐步替换成国产品牌,“填料主要还是用国外的;质粒方面,国产和进口质量其实差不多,但价格只有进口的1/3,我们后面的药就用国产的。”纽福斯创始人、CEO李斌表示,已享受到国产替代的红利。
另外,在保供安全性方面,由于细胞疗法是个性化治疗的产品,需要现时采集病人的细胞生产;且现阶段该疗法针对的多为难治、复发血液瘤病人,如果生产供应链环节出了问题,导致供应不及时,可能会直接影响治疗结果。因此,对供应链上下游均有一定把控力、避免因不可抗力带来的影响,也成为企业选择国产替代的一项原因。
对于生物医药制造环节的国产替代,也有行业人士理性表示:一定要保证开发过程中药品的疗效,不能“为了国产替代而替代”。对于正在供应设备或原料的国产厂商而言,考虑到创新的研发成本,一味降价并非是国产企业的出路。要和GE、丹纳赫等供应链企业PK,并不能只靠低价,还是要从提高器械和试剂性能的方方面面去竞争。
随着国产替代进程的推进,生产制造环节成本的降低,意味着企业有了相对更低的试错成本。但对于生物科技企业而言,相比于生产成本,高昂的研发费用是成本项中更重的一块。多位专家都表示,即便生产成本降低,细胞与基因治疗的药品“也不能卖出白菜价”。天价药之所以存在,也是为了通过终端的盈利,不断反哺药企的研发,让其具备源源不断开发的资源支持。
因此,从短中期来看,在技术尚未实现颠覆性突破的情况下,无论是CAR-T等细胞疗法,还是针对罕见病患者的基因治疗,短期内仍将是少部分人能够负担得起的“奢侈品”。
技术待突破,去“卷”海外市场
现阶段,细胞与基因治疗领域仍有诸多技术难题待攻克,一来自体CAR-T制备成本高,二来主要应用于血液瘤后线治疗、遗传性罕见病等,在实体瘤领域尚无重大突破,导致针对患者群体有限,部分企业在商业化上面临挑战,难以实现销售峰值。因此,通用型CAR-T产品,及针对实体瘤的产品成为药企研发热点。
自体CAR-T细胞疗法在血液瘤领域有可观疗效,但受制于其个体化、复杂的制备过程,导致其造价昂贵,且流程中的任一失误都可能导致CAR-T制备的失败。因此针对自体CAR-T细胞的不足,研发者提出了“通用型CAR-T”(UCAR-T)的概念,即从健康供体体内获取T细胞,再通过基因工程技术制备成CAR-T细胞,以实现批量生产,降低成本。
但是,通用型CAR-T产品必须要翻越“两座大山”,才能在患者体内存活,并有效识别、杀死肿瘤细胞。一是异体CAR-T对宿主的攻击;二是宿主对CAR-T细胞的免疫排斥反应。
目前海内外已有多款通用型CAR-T处于临床研究阶段,国内北恒生物、亘喜生物、驯鹿生物等细胞治疗企业都在研发通用型CAR-T产品。进度较快的如北恒生物,产品已获NMPA临床试验默示许可,用于治疗成人复发或难治性急性B淋巴细胞白血病(r/r B-ALL)。
与此同时,随着针对实体瘤,高表达、适合CAR-T开发的靶点不断被发现,也使得该领域的临床管线快速增长,典型如肺癌高表达的GPC3,胃癌、胰腺癌高表达的CLDN18.2等。
细胞疗法用于实体瘤,可想象的商业前景更为广阔,但是在技术上仍有待解难题:例如,实体瘤存在物理性的肿瘤屏障,如肿瘤基质,会限制CAR-T细胞的迁移和渗透,导致其只能浸润肿瘤浅表,却无法渗透至内部。且一些实体瘤会抑制某些趋化因子的分泌,阻断趋化因子促进T细胞向肿瘤微环境迁移的功能。现阶段药企试图通过尝试不同给药方式,或通过基因改造增强CAR-T的穿透性,来解决实体瘤疗效不佳的问题,但相关方法仍有待进一步的临床有效性的验证。
商业化方面,多家细胞与基因治疗企业将海外市场作为上市的第一站,通过FDA的审评审批机制,在支付方式更为多样的欧美市场站住跟脚,成为众多企业出海的目标。但目前除已有产品上市的传奇生物外,多家CGT已启动海外临床申报的企业尚未有进入临床后期者,CGT企业出海进程仍待观察。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。