Nature | 首个CRISPR基因编辑TCR-T疗法I期临床数据公布,癌症细胞免疫治疗有望迎来新飞跃
美国生物技术公司PACT Pharma的研究人员在Nature发文报道,开发了一种基于CRISPR/Cas9非病毒精准基因编辑的临床级方法,可同时敲除内源性T细胞受体(TCR)基因和敲入新抗原特异性TCR(neoTCR)基因。这是将癌症研究的两个热门领域个体化基因编辑和抗癌细胞疗法结合起来的一次新尝试 。研究还公布了该疗法的首个人类I期临床试验(NCT03970382)数据。

任何癌症治疗的最终目标都是靶向并杀死癌细胞,同时保留正常细胞。由于TCR的精准特异性,人类免疫系统特别适合于实现这一目标。然而,这一目标受到人群中HLA I类等位基因的巨大多样性,以及T细胞识别的绝大多数突变抗原决定簇多态性的限制。这就是目前大多数TCR工程T细胞治疗仅限于HLA-A:02*01单倍型患者的原因。而突变肽HLA TCR结合试剂阵列的产生和成对TCR链的单细胞克隆提供了一种新的方法来分离跨多个HLA等位基因的neoTCR。
此外,以前的人类T细胞工程依赖于重组病毒载体的使用,但不可能为每个接受治疗的患者生成多个个性化的临床级载体。基于核酸酶(如CRISPR/Cas9)的精确基因编辑的出现允许开发将转基因靶向插入人类T细胞的更优方法 。CRISPR不仅能敲除特定的基因,还能在免疫细胞中插入新的基因,有效地重定向免疫细胞,以识别患者自身癌细胞中的突变。当输回患者体内时,这些CRISPR工程免疫细胞优先输送到癌症。
在这项工作中,研究人员利用个体患者HLA I类等位基因所呈现的数百个预测新抗原肽序列的个性化文库,经多轮筛选和验证,找到肿瘤突变neoTCR。接着,研究人员从每个受试者身上采集血液样本,并使用CRISPR基因编辑将这类TCR的基因序列插入他们的T细胞中。然后,每个受试者经过清淋治疗后注入工程细胞。
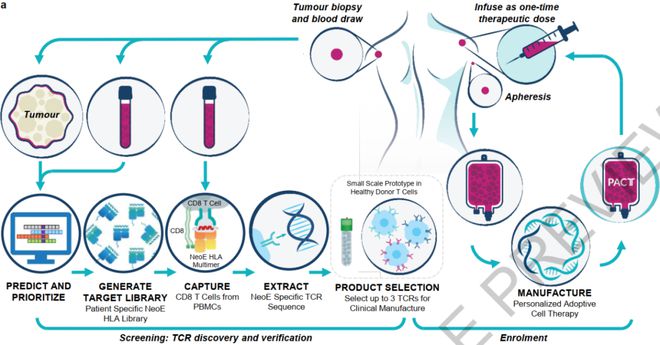
来源:Nature
16例患者接受了多达3种不同靶标的工程T细胞。之后,研究人员发现编辑过的T细胞在肿瘤部位比未编辑过的T细胞浓度更高。治疗一个月后,其中5例患者经历了SD(疾病稳定),这意味着他们的肿瘤没有生长。2例患者经历了可能和细胞治疗相关的副作用。
有了这个初步的概念验证,研究人员表示,希望能够设计不仅可以识别癌症突变,还可以在肿瘤附近更加活跃的T细胞。通讯作者Stefanie J. Mandl说:“有几种潜在的方法来加强T细胞,如通过去除对免疫抑制信号做出反应的受体,或者通过调整它们的代谢,以便它们更容易在肿瘤环境中找到能量来源。”
随着近年来使用CRISPR编辑T细胞的技术进步,这种设计可能是可行的,费城宾夕法尼亚大学研究癌症治疗细胞和基因疗法的Avery Posey说:“我们有望在未来十年内看到非常复杂的免疫细胞工程方法。”
非病毒基因编辑方法的多功能性,允许在一个步骤中敲除和敲入几个基因。预测在不久的将来,临床方法将能够结合额外的基因编辑,以改善T细胞功能,避免T细胞耗竭,允许T细胞在反复接触抗原的情况下持续对抗原应答,避免实体肿瘤微环境中的免疫抑制因子,允许体内扩增,甚至不需要清淋调节化疗。
总的来说,这项研究证明了以下几点可行性:分离和克隆识别突变新抗原的多个TCR;使用单步非病毒精准基因编辑同时敲除内源性TCR和敲入neoTCR;制造临床级neoTCR工程化T细胞;输注高达3种基因编辑的neoTCR-T细胞产品的安全性。此外,研究还证明了转基因T细胞运输至患者肿瘤的能力。
这项工作建立在基因组编辑的开创性研究的基础上,以转基因TCR工程化重定向T细胞特异性,为实体癌患者制造广泛适用的、肿瘤特异性的个性化T细胞疗法。
参考资料:
[1]Susan P. Foy et al. Non-viral precision T cell receptor replacement for personalized cell therapy. Nature(2022)
[2]https://www.nature.com/articles/d41586-022-03676-7
[3]https://medicalxpress.com/news/2022-11-crispr-substitute-genes-patients-cancer.html
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。