基因治疗:通过表达工程化受体实现AAV转导的组织特异性

转基因活体小鼠模型对许多领域的生物医学研究产生了巨大的影响,包括肿瘤学、神经生物学、遗传性遗传疾病和传染病。这些研究通常需要转基因的组织特异性表达,以更好地反映人类疾病。组织特异性可以通过构建转基因小鼠模型来实现,通过细胞类型特异性启动子来驱动表达或细胞类型特异性Cre重组酶的整合。然而构建转基因小鼠既耗时又昂贵,而且每个基因都需要新的模型,这严重限制了研究的广度和规模。利用病毒载体进行转基因表达提供了另一种选择,它允许以较低的成本和工作量在小鼠中瞬时表达基因。腺相关病毒(AAV)已经成为体内转导的首选病毒载体,并被用作评估基因功能的重要研究工具。此外AAV已成为治疗遗传病的核心平台,已有多个已批准的药物产品和其他临床开发的药物。在小鼠模型中使用AAV的局限性包括难以转导的细胞类型和难以实现组织特异性。

2023年6月8日,来自斯坦福大学医学院的Helen M. Blau团队和Jan E. Carette团队合作在Nature Methods杂志上发表了题为“Hardwiring tissue-specific AAV transduction in mice through engineered receptor expression”的文章。在这里他们通过结合AAV介导的转基因递送的多功能性和特定细胞类型的Cre介导的重组的特异性产生了一个强大的体内转基因传递系统。他们的方法利用了AAV转导对其受体AAVR表达的绝对依赖性,由于几乎所有AAV的自然和工程衣壳变体都需要AAVR,因此该方法与各种现有的AAV载体兼容,可以根据研究问题灵活选择AAV变体。该系统允许通过与现有的Cre小鼠品系杂交来产生具有AAVR特异性过表达的小鼠,以及当与Aavr-KO小鼠配对时,可以选择从其他组织中去除AAV。通过调节其受体的表达来调控AAV的转导,该方法能够实现对特定细胞表达AAV载体转基因的精确控制。
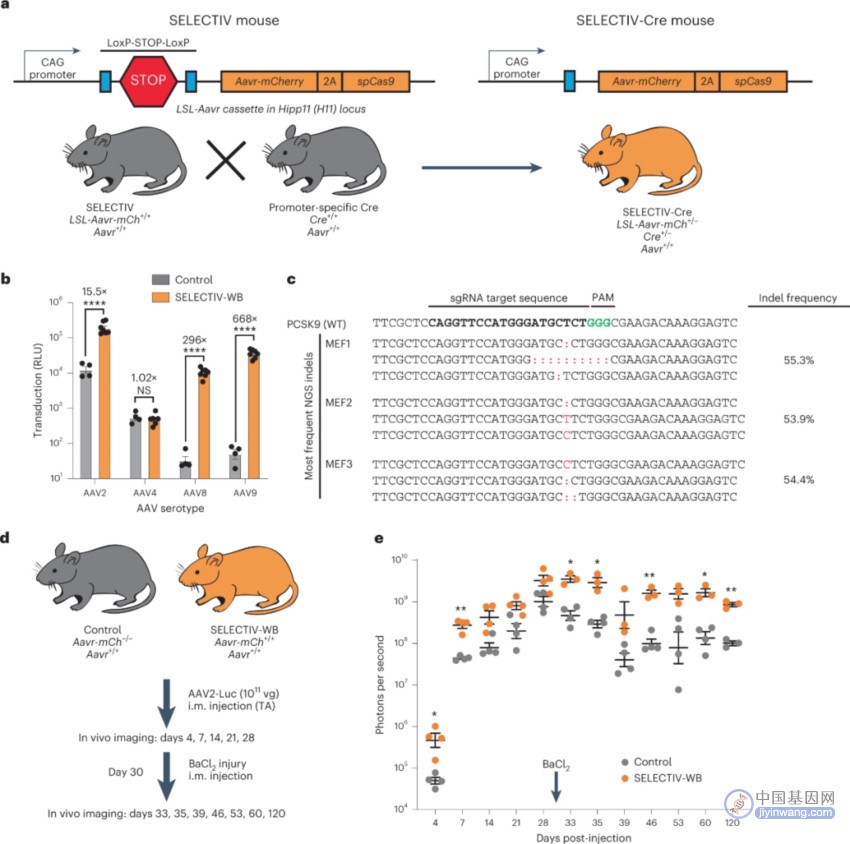
图1 AAVR在小鼠体内高效表达平台的构建及鉴定
假设AAV转基因的表达可以通过选择性过表达AAVR来靶向特定的组织或细胞类型。为了控制AAVR的表达,他们设计了一个Cre介导的AAVR过表达盒(图1A),含有这种基因盒的小鼠被命名为SELECTIV。评估了来自对照(Aavr+/+)或SELECTIV-WB胚胎的小鼠胚胎成纤维细胞(MEF)中AAV的转导作用。将三个AAVR依赖的血清型(AAV2、AAV8和AAV9)和一个编码荧光素酶的AAVR非依赖型(AAV4)(图1B)转导了对照和SELECTIV-WB MEF。AAV4转导不受AAVR过表达的影响,AAVR过表达显著增加了AAVR依赖的三种血清型的转导。在SELECTIV构建体中引入了spCas9,以允许通过AAV递送靶向目的基因的sgRNA进行基因KO实验。用编码靶向PCSK9的sgRNA的AAV9转导SELECTIV WB MEFs,这导致了有效的基因组编辑 (图1C)。
在动物模型中使用AAV通常需要高病毒滴度才能在体内实现足够的转基因表达,且某些细胞类型对AAV转导具有更强的耐受性。由于AAV的载体被广泛用于研究和治疗肌肉疾病,他们首先关注了肌肉的转基因递送。全身AAVR过表达的小鼠(SELECTIV-WB)和对照小鼠(AAVR+/+)肌肉注射AAV2-荧光素酶(图1D)。为了测试转基因表达的持久性,将BaCl2注射到转导的肌肉中来损伤肌肉。使用体内成像跟踪荧光素酶活性随时间的变化(图1E),与对照组相比,AAVR过表达导致转导显著增加,且转基因的表达增强在损伤后仍然存在。
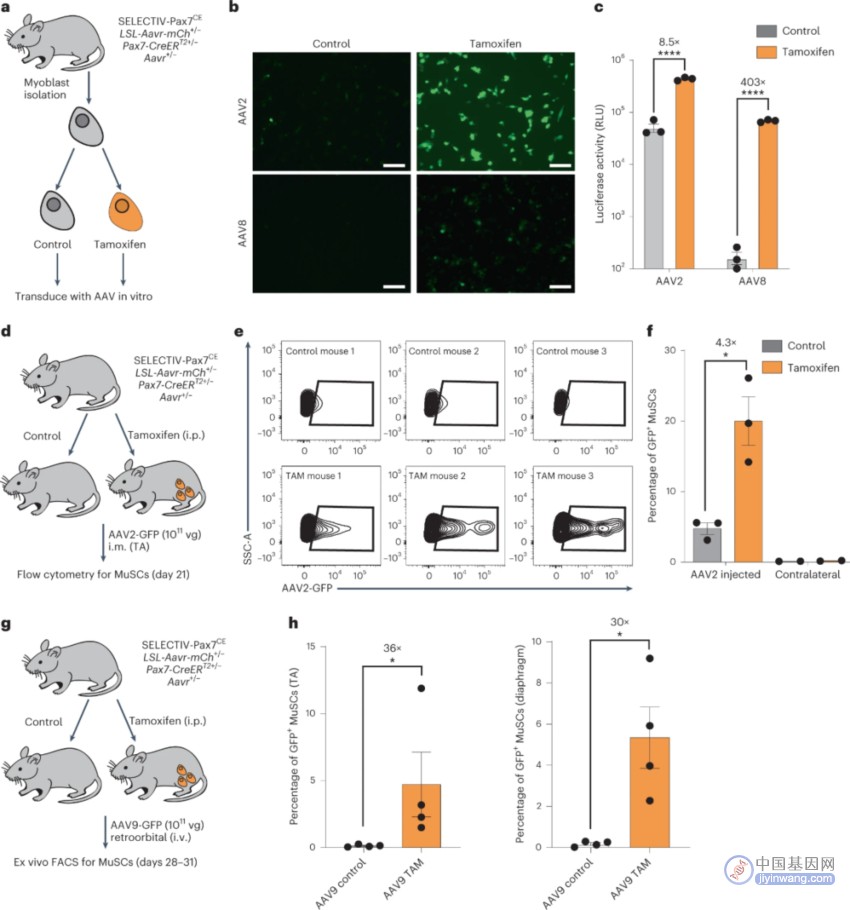
图2 在体内和体外靶向诱导MUSCs的AAVR过表达可增加AAV的转导
在SELECTIV-WB小鼠中,假设AAV转导持续比对照组强是AAV对肌肉干细胞(MuSC)的转导增加所致,它是受损肌肉再生所必需的。许多AAV血清型转导MUSC效率很低,有人认为MUSCs的静止状态或独特的微环境会导致AAV转导不良。这里建立了SELECTIV-Pax7CE小鼠,使他莫昔芬诱导的AAVR在MuSCs中过表达。该系统首先用来自SELECTIV-Pax7CE小鼠的MUSC来源的原代成肌细胞进行体外测试,这些细胞经他莫昔芬或对照处理并用AAV2-或AAV8-GFP转导(图2A)。荧光显微镜显示AAVR过表达增加了转导效率(图2B)。对转导进行量化,AAVR过表达增加了AAV2和AAV8的转导(图2C)。这些结果强调了AAVR的表达对于高效体外MUSC转导的关键作用。
接下来通过肌肉注射AAV2-GFP到他莫昔芬处理的和对照未处理的SELECTIV-Pax7CE小鼠中,评估了体内MUSC的转导(图2D),21d后检测到MUSCs绿色荧光蛋白的表达(图2E,F)。对照组小鼠有少量的MUSCs转导,而AAVR过表达使MUSC转导增加4倍以上。因此AAVR的表达是AAV转导的一个限制因素。之后测试了系统注射AAV后MUSCs的转导(图2G)。这些结果证明了AAVR在体内转导MUSC中的显著作用,这表明MUSCs的静止状态或微环境对于转导的影响不大,或者这些因素可以通过AAVR的过表达来克服。
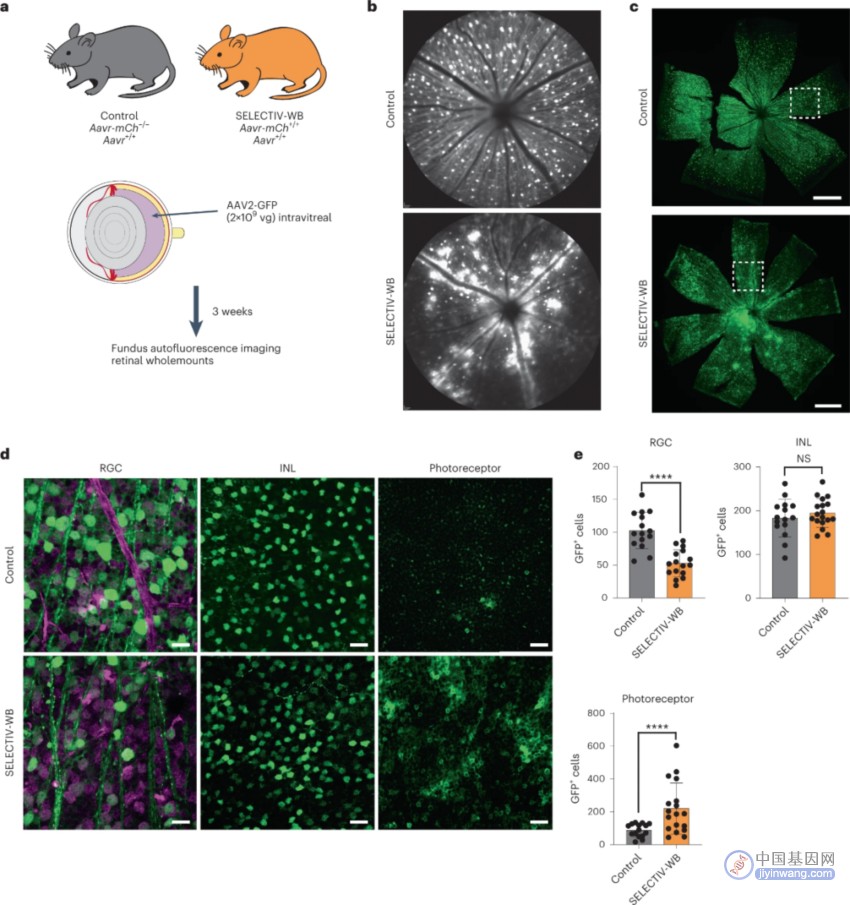
图3 AAVR的过表达改变了静脉注射时对眼睛光感受器层的转导模式
为了进一步评估SELECTIV系统在小鼠中提供快速和灵活表达系统的效用,他们将其应用于视网膜。在玻璃体内注射AAV2-GFP后,评估了转导差异(图3A),SELECTIV-WB小鼠在沿着血管的区域有大面积的强转导(图3B)。组织学分析显示,转导存在于两组视网膜神经节细胞(RGCs)的视网膜内层(图3C)。然后通过联合标记RGCs、无长突细胞和感光细胞来评估AAV对RGCs的转导。发现GFP在RGC中有强表达 (图3D),细胞定量显示SELECTIV-WB组感光层转导显著高于对照组;RGC层转导低于对照组;INL转导和对照组相似(图3E)。这些结果表明,玻璃体内注射AAV2后AAVR的表达影响细胞类型特异性和转导深度。AAVR的过表达允许小鼠视网膜内外层的转导,并更深入地转导到感光细胞。SELECTIV系统已经证明,AAVR过表达可以提高转导视网膜的效率,而不需要进行更复杂、更深入的程序,如视网膜下注射。
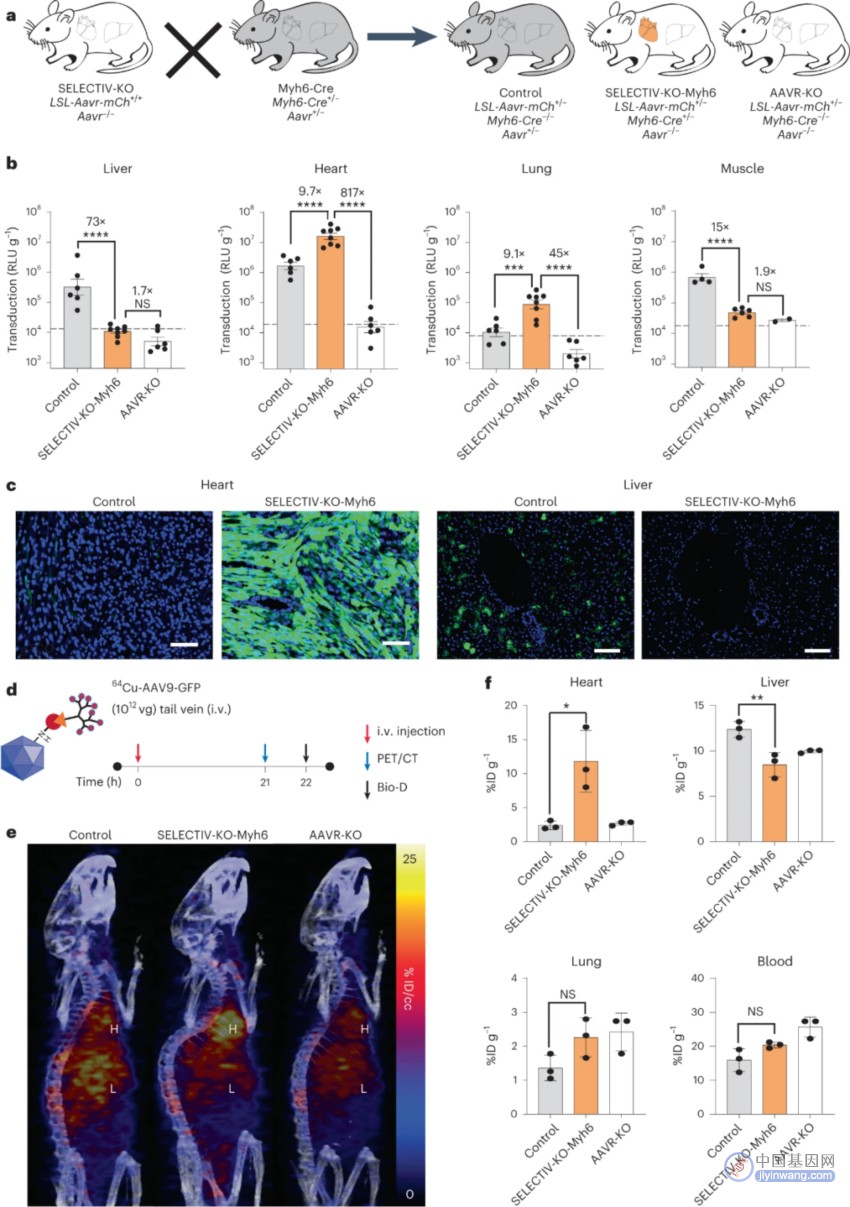
图4 SELECTIV-KO平台允许对感兴趣的组织进行有效的转导,同时在系统递送AAV后几乎消除对非靶组织的转导
他们推断培育内源性AavR纯合失活的SELECTIV小鼠(SELECTIV-KO小鼠)将有效地阻止所有非靶细胞类型的转导。将表达组织特异性启动子的Cre的小鼠品系与SELECTIV-KO小鼠相结合,将产生具有高效和细胞类型选择性AAV转导的小鼠。培育的SELECTIV-KO-Myh6小鼠在心肌细胞表达Cre,在肺血管平滑肌细胞适度表达,而内源性Aavr不表达(图4A)。使用的是不表达Cre和AavR杂合子的小鼠作为对照。为了评估AAV9-Luc在这些小鼠中的转导作用,通过静脉系统注射了AAV9-Luc。对照组小鼠的肝脏、心脏和肌肉中的荧光素酶活性较高,而肺中的荧光素酶活性较低。而SELECTIV-KO-Myh6小鼠心脏和肺中的荧光素酶活性几乎是对照组的10倍,肝脏和肌肉中的荧光素酶活性水平降低到接近本底水平。这些低表达与在AAVR-KO小鼠中观察到的类似,其内源性AAVR缺失但不重新表达AAVR(图4A,B)。之后用不同的转基因和AAV载体证实这些发现(图C)。由于AAVR直接与AAV颗粒结合,并在组织培养中迅速从细胞表面内吞,推测它可能会影响AAV颗粒在体内的生物分布。使用正电子发射计算机断层显像(PET)在系统静脉注射(图4D)后不久跟踪64Cu标记的AAV9载体的分布,这些结果表明AAVR的表达影响AAV颗粒的生物分布和转导。
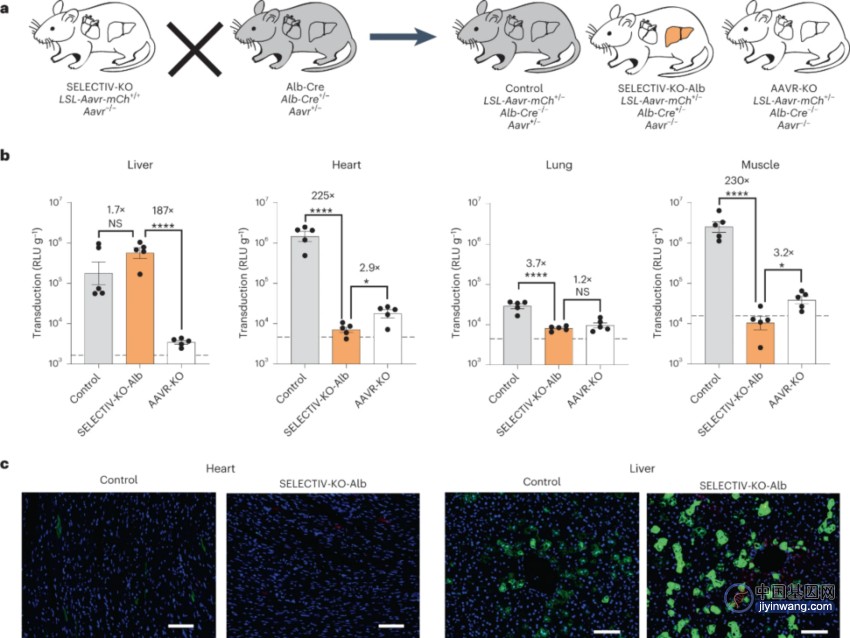
图5 SLECTIV-KO系统的转导特异性受Cre小鼠品系选择的严格控制
为了证明SELECTIV-KO平台的多功能性,他们利用在肝细胞中表达Cre的Alb-Cre小鼠品系将分析扩展到肝脏特异性表达。这些结果提供了强有力的证据,表明SELECTIV-KO平台允许在靶组织中进行有力的转导,同时阻止在非靶组织中的转导,其特异性由所选的Cre-表达体系的小鼠品系决定。
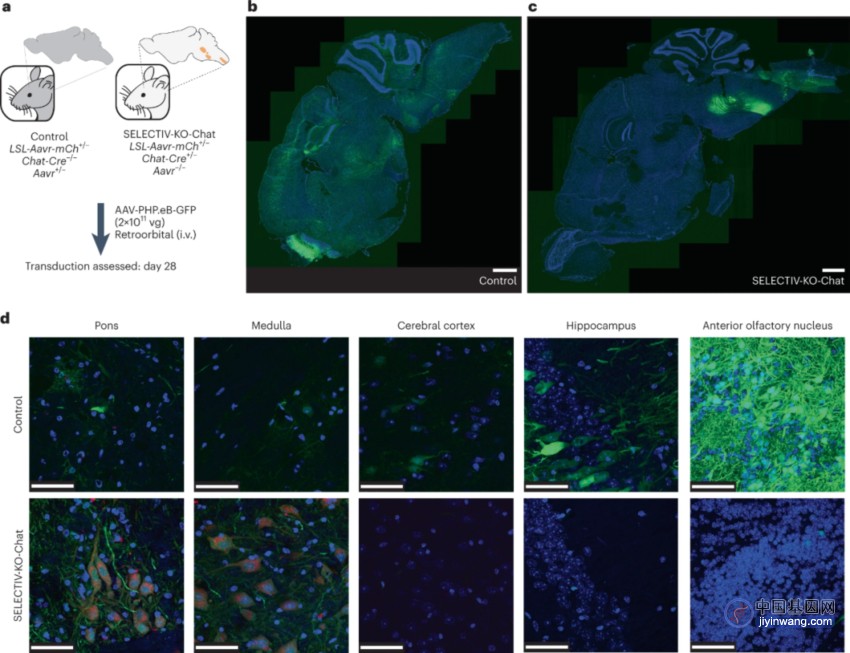
图6 AAVR在神经元亚群中的选择性表达在全身递送时将AAV转导靶向大脑中的特定区域
小鼠是研究神经功能和神经障碍的模型,这通常需要在特定的神经元亚群中进行转基因表达。最近,AAV变异体被用于非侵入性全身给药后将基因转移到成年啮齿类动物的脑中,如AAV-PHP.eB可以更有效地穿越血脑屏障。在这里使用了仅在胆碱能神经元中表达Cre重组酶的Chat-Cre小鼠,给SELECTIV-KO-Chat和对照组小鼠静脉注射编码GFP的AAV-PHP.eB(图6A)。正如之前报道的,AAV-PHP.eB有效地转导成年小鼠大脑的许多区域,驱动广泛的转基因表达(图6B)。然而在SELECTIV-KO-Chat小鼠中,GFP的表达受到更多的限制,GFP阳性细胞集中在延髓和脑桥的特定区域(图6C)。在SELECTIV-KO-Chat小鼠中的转导具有高度的特异性,在非靶细胞中没有GFP表达,而在对照组小鼠中有效地转导了这些细胞,包括大脑(大脑皮层、海马体和前嗅核)(图6D)。这些结果表明在全身注射后,SELECTIV-KO平台可以将AAV靶向转导到大脑中特定的神经元。这些实验可以使用现成的AAV载体进行,不需要专门的设备或技术,也不需要侵入性程序。
在特定细胞类型中表达感兴趣基因的转基因小鼠模型的发展改变了我们对基础生物学和疾病的理解,然而生成这些模型是时间和资源密集型的。在这里,研究者描述了一个模型系统:体内的选择性表达和受控转导(SELECTIV),通过将AAV载体与Cre诱导的多血清型AAV受体的过表达相结合,实现了转基因的高效和特异性表达。转基因AAVR的过表达极大地提高了许多不同类型细胞的转导效率,包括肌肉干细胞,AAV转导对这些细胞通常无效。通过结合Cre介导的AAVR的过表达和全身性敲除内源性AAVR,可以获得更好的特异性,这在心脏心肌细胞、肝细胞和胆碱能神经元中都得到了证实。SELECTIV增强的效力和特异性在开发新的小鼠模型系统方面具有广泛的实用价值,并扩大了AAV在体内基因传递的应用。
原文链接:https://doi.org/10.1038/s41592-023-01896-x
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。